

مقدمه:
بیماری تب برفکی یکی از مسری ترین بیماریهای ویروسی در حیوانات زوج سم می باشد و قادر است آسیبهای اقتصادی شدیدی به دامهای حساس و مبتلا وارد سازد. ویروس عامل این بیماری در هفت تیپ اصلی به نامهای O،A،C،SAT1،SAT2،SAT3 و Asia 1 تقسیم بندی می شود. باید توجه داشت که آلودگی به یک سروتیپ ویروس، دام را در برابر سایر سروتیپ ها مصون نمی سازد.
بیماری تب برفکی از نظر علائم بالینی با سایر بیماریهای وزیکولی مانند بیماری وزیکولار اگزانتما و استوماتیت وزیکولی خوک قابل تفکیک نبوده و به همین دلیل تشخیص قطعی با آزمایشهای تشخیصی قابل انجام است.
وقوع بیماری تب برفکی با ایجاد طاول در سم، قسمت مخاطی دهان و در ماده ها روی پستان همراه است. این بیماری بصورت خفیف تا بسیار حاد و مرگ ومیر بخصوص در بین دامهای جوان بروز می کند. البته لازم به ذکر است که در برخی گونه ها مانند گاو میش نوع کافر آفریقایی ( Syncerus caffer)، ممکن است این عفونت بطور تحت بالینی نیز دیده شود.
بهترین منبع ویروس، مایع داخل طاول و نیز تکه های بافت اپیتلیوم آلوده می باشد. در صورت دسترسی به آن، می توان با جمع آوری ترشحات حلق و مری در گاوها و گوساله ها و یا با استفاده از سوآب حلق در خوکها می توان ویروس را جدا نمود. همچنین در جنینهای تلف شده بافت عضله قلب و خون بدین منظور مناسب می باشند ولی با تمام این مطالب، طاول ها بهترین محل برای جداسازی ویروس می باشند. پس از تهیه نمونه ها، جهت ارسال به آزمایشگاه های مجهز، اجرای شرایط خاص مطابق با استانداردهای OIE ضروری می باشد.
به منظور تشخیص اولیه بیماری FMD ،پس از مشاهده علائم بالینی می توان از آزمایشهای مختلف نظیر ثبوت مکمل (C.F.test) (بخصوص برای شناسایی تیپ های مختلف ویروس)، الایزا (ELISA) و رسوب دهی در آگار ژل جهت شناسایی پادتن ایجاد شده علیه ویروس تب برفکی استفاده نمود. که البته آزمون الایزا نسبت به ثبوت مکمل حساستر بوده و در این روش عوامل ضد مکمل (Anti-complement factors) سبب تداخل در نتایج نمی شوند.
اگرچه در اغلب موارد شناسایی آنتی ژن و یا اسید نوکلئیک ویروس تب برفکی توسط آزمونهای ثبوت مکمل و روشهای مولکولی نظیر PCR برای اثبات بیماری کفایت می کند ولی به علت اهمیت این ویروس و واگیری بالای آن، جداسازی ویروس و شناسایی کامل آن جهت بررسی های همه گیر شناسی ضروری می باشد که البته به علت حساسیت بالای تب برفکی، باید این عمل تحت شرایط خاص Biosafety مورد تأیید OIE، انجام پذیرد.
به منظور جداسازی ویروس تب برفکی، با استفاده از محیطهای کشت سلولی مختلف نظیر کلیه نوزاد همستر (BHK-21)، سلولهای تیروئید گوساله و بره و یا کلیه آنها و نیز سایر تیره های سلولی و همچنین با تزریق مایع داخل وزیکول به بچه موش 2 تا 7 روزه می توان ویروس فوق را تکثیر نمود. در محیط کشت، پس از ایجاد تخریب سلولی در 100% نمونه ها، میتوان جهت شناسایی آنها، از روشهایی نظیر RT-PCR ، ثبوت مکمل استفاده نمود و حتی برای مشاهده ویروس، از میکروسکوپ الکترونی بهره برد. در بچه موشها نیز پس از بروز علائم فلجی، تمامی اعضاء بدن حیوان برای جداسازی ویروس مناسبند.
برای ارزیابی سرمی این بیماری نیز چنانچه در دامهای واجد طاولهای مذکور که قبلاً علیه بیماری تب برفکی واکسینه نشده باشند، وجود پادتن اختصاصی علیه پروتئین های ساختاری ویروس فوق، حکایت از آلودگی دام خواهد داشت. آزمونهای سرمی در مواقعی که عفونت خفیف بروز کرده باشد و یا دستیابی به بافت اپیتلیوم آلوده میسر نباشد، کاربری دارند. از طرفی نیز بررسی وجود آنتی بادی ضد پروتئینهای اختصاصی نیز در گله های واکسینه، نشان دهنده وجود آلودگی قبلی یا رایج به ویروس وحشی (سویه غیر واکسن) می باشد.
از آزمونهای سرمی اختصاصی پروتئینهای ساختمانی جهت تعیین سروتیپهای ویروس تب برفکی، آزمایش خنثی سازی ویروس(Virus Neutralization) و الایزا می باشد. البته اگرچه VN در مقایسه با الایزا حساسیت بیشتری دارد ولی کندتر و با هزینه بیشتر نسبت به آن انجام می شود . از طرفی به علت نیاز به کشت سلولی در این روش و احتمال بروز آلودگی در محیط فوق، ممکن است در نتایج آن اختلال ایجاد گردد. بنابراین آزمایش الایزا به انجام سریع، حساسیت مناسب و پاسخ بهتر و از طرفی استفاده از آنتی ژن غیر فعال و عدم امکان بروز آلودگی ،که در محیط کشت وجود دارد، نسبت به VN برتری دارد.
به منظور پیشگیری بیماری تب برفکی، رعایت اصول بهداشتی در سطح منطقه و گله ها اهمیت بسیاری دارد و در مرحله بعدی از واکسیناسیون به عنوان یکی از راه های اصلی جهت پیشگیری از وقوع و گسترش این بیماری در مناطق آلوده استفاده می شود.
در حال حاضر استفاده از واکسنهای غیر غعال (کشته) تجاری رایج می باشد که از طریق آلوده نمودن محیطهای کشت سلولی حساس بصورت یک لایه (Monolayer) و یا کشت معلق (Suspension) و سپس ***** نمودن آن، آنتی ژن مورد نیاز در تولید واکسن، به دست می آید و سپس به وسیله اتیلن امین (Ethyleneimine) آنها را غیر فعال نموده و پس از افزودن یاورهای مناسب، مخلوط و سلایه می کنند و بصورت واکسنهای مونووالان و پلی والان (حاوی چند سروتیپ) عرضه می شوند. به منظور ارزیابی واکسنها از نظر عدم وجود ویروس فعال بیماریزا، همواره باید آزمایشات کنترلی invivo و invitro انجام گیرد تا از بی ضرر بودن و مؤثر بودن آنها اطمینان حاصل گردد. میزان حفاظت واکسنهای فوق باید بر مبنای PD50 (50 درصد Protective Dose ) محاسبه شود.
لازم به ذکر است، سرمهای تشخیصی هر 7 سروتیپ ویروس تب برفکی در آزمایشگاهای مرجع مورد تأیید OIE و FAO ، در پربرایت انگلستان موجود بوده و همواره پس از ارسال نمونه های مشکوک از سراسر دنیا، جهت تشخیص دقیق، مورد استفاده قرار می گیرند.
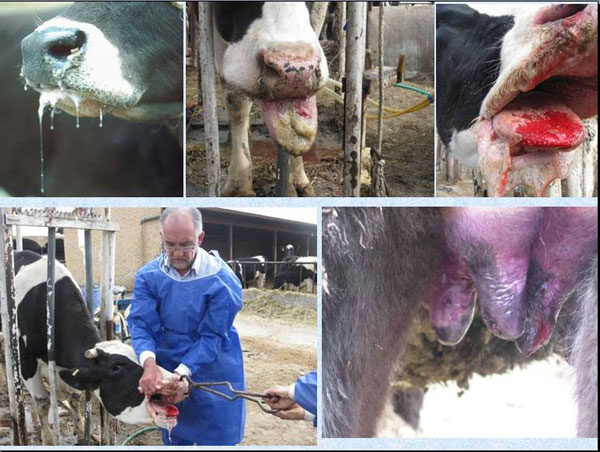
تصویر (1): علائم و جراحات ناشی از بیماری تب برفکی در گاو: الف وب:افزایش ترشح بزاق، ج و د: طاول پاره شده روی زبان و مخاط دهان ، ه: طاول ها روی نوک پستان، و:طاول پاره شده در سم
در ادامه به منظور آشنایی بیشتر، اصول واکسیناسیون در بیماری تب فرکی به تفصیل شرح داده می شود؛
1-تعریف واکسن و اساس مایه کوبی
بر اساس بسیاری از منابع موجود تصور بر این است که ایمنی بخشی یا ایمن سازی برای اولین بار توسط ادوارد جنر انگلیسی در سال 1796 به وسیله تزریق ویروس آبله گاوی به انسان (به علت نزدیکی آنتی ژنیکی) انجام داد و در این مورد موفیتهایی بدست آورد. لویی پاستور نیز همین راه را دنبال نمود و در مورد سیاه زخم (شاربن) و یا ویروس هاری که از راه های گوناگون تخفیف حدت یافته بودند موجب برقراری ایمنی در دام یا انسان دریافت کننده واکسن گردید.
همانطور که اطلاع داریم ابتدا ایمنی را فقط در خون یعنی بصورت ایمنی همورال (Humeral immunity) می توان یافت ولی بتدریج متوجه شدند که ایمنی منحصر به خون نیست بلکه ایمنی سلولی (Cellular immunity) در خیلی از بیماریهای ویروسی نقش مهمتری از نظر پیشگیری بیماری دارد و همین امر راه را برای تهیه و تولید واکسنهای زنده هموار نمود. از این زمان به بعد تهیه واکسنها از دو راه دنبال شد: یکی تهیه و داشتن آنتی ژن و غیر فعال نمودن آن (Inactivated vaccine) اعم از باکتریایی یا ویروسی و راه دوم استفاده از واکسنهای زنده یا تخفیف حدت یافته (Live attenuated vaccine) که چنانچه موفق شویم قسمت عفونتزای ویروس را حذف کنیم و بخش ایمنی زایی آنرا کاملاً حفظ نموده و این مایه را به حیوان حساس تزریق کنیم، ایمنیت با دوام و شاید در پاره ای از واکسنها، مادام العمر (Life time) بدست خواهیم آورد.
در چند سال اخیر از مهندسی ژنتیک (Genetic engineering) استفاده شده و بیوتکنولوژی در عرصه تولید وارد شده است که گامی بزرگ در راه ریشه کنی پاره ای از بیماریهای کشنده دامی مانند طاعون گاوی (Rinder pest) و یا بیماری خطرناک فلج اطفال (پولیومیلیت) که کاملاً تحت کنترل قرار گرفته است، می باشد. مهمترین وسیله دفاعی که پروردگار توانا در اختیار گذاشته است حضور عواملی است تا به مبارزه علیه عوامل بیماریزا اقدام کنند که شرح کامل آنها از حوصله این مقاله خارج است ولی از همه مهمتر ترشح پادتن علیه عامل آلودگی و دیگری ایمنی با واسطه سلولی (Cell Mediated Immunity) می باشد.
با توجه به مطالبی که گفته شد واکسن یعنی همان ماده بیولوژیکی که تهیه شده و از هز راهی آنرا وارد بدن دام یا انسان نمائیم، دریافت کننده پادگن قادر است پادتن اختصاصی همان ماده یا ویروس را تهیه وبه مبارزه برخیزد. بنابراین اثر واکسیناسیون روشی است که اجتماع وسیعی از انسان، دام و یا طیور را در یک زمان واحد و معین علیه یک بیماری مورد نظر ایمن سازد تا بیماری همه گیر خاموش گردد.
زمینه های متعددی موجود است که در یک زمان بیماری شیوع پیدا میکند که نسبت به هر بیماری متفاوت است. حتی در اشاعه بیماری ویروسی شواهد زیادی داریم که روش اشاعه گوناگون می باشد. مثلاً درباره طاعون گاوی حتماً بایستی دام آلوده و مبتلا در برابر دام حساس قرار گیرد تا بیماری منتقل شود. اما برعکس در بیماری تب برفکی (FMD) انتقال ویروس از هر راهی امکان دارد. حتی باد یا عوامل دیگر. در مورد اشاعه بیماری تب برفکی از غرب قاره اروپا به انگلستان که از طریق باد ویروس حاد از کانال مانش عبور کرد و موجب آلوده شدن دامهای حساس جزیره بریتانیا شد که دولت انگلستان به ناچار با روش معدوم سازی (Stamping out) تمام مبتلایان را از بین برد و مجبور به پرداخت مبلغ قابل توجهی غرامت به صاحبان دامها گردید که فراموش نمی شود.
2-واکسنهای زنده ویروسی تخفیف حدت یافته شده
اگر پیشرفتی بدست آید و بتوان ویروسی را تخفیف حدت دهیم، واکسن زنده ای تهیه می شود که می توان گف بهترین نوع واکسن خواهد بود، بخصوص از نطر بی ضرری و کیفیت بالای ایمن بخشی آن. نمونه بسیار بارز و خوب این نوع واکسنها، واکسن طاعون گاوی تخفیف حدت یافته سویه پروفسور والتر پلورایت (W. Plowright) است که از عبور بر روی سلولهای زنده کلیه گوساله استفاده نمود. بزرگترین امتیاز این نوع واکسنها جلوگیری از ورود و اشاعه بیماری های دام یا انسان می باشد.
بیشتر واکسنهایی از این دسته زیر جلدی یا داخل عضلانی تزریق می شوند ولی بعضی ها هم بصورت اسپری یا محلول آشامیدنی در آب مصرف می شوند. ویروس واکسنهای زنده در موجود گیرنده واکسن تزاید یافته و موجب بالا رفتن ایمنیت حتی برای تمام عمر می شوند. در بعض موارد ممکن است بیماری مختصری ایجاد کنند که زودگذر است و اثر نامطلوبی بر جای نمی گذارد.
واکسنهایی که بصورت طبیعی و اتفاقی بوجود آمده اند و در روند پیشرفت فن آوری ساخت واکسن نقش بسزایی داشته اند در ادامه شرح داده می شوند؛ کلمه واکسن از لغت لاتین Vacca به معنی گاو اقتباس شده است و در واقع ادوارد جنر (E .Jenner) انگلیسی بسال 1798 سویه ای از آبله گاوی ( Cow pox) را برای ایمنی زایی در انسان علیه بیماری آبله انسان(Small pox) که بسیار شایع بود، بکار برد و از آن زمان به بعد کلماتی مانند واکسن و واکسیناسیون متداول شده است. واکسن آبله گاوی بعلت قرابت آنتی ژنیکی با ویروس آبله انسان بخوبی توانست انسان را در برابر آبله طبیعی مقاوم سازد و از نظر بهداشتی بسیار با اهمیت بود.
در چند سال اخیر همین پدیده در مورد سایر بیماریها اتفاق افتاده است بطور مثال مقاوم کردن طیور علیه بیماری مارک با ویروس هرپس ویروس بوقلمون یا ایمنیت دادن به بچه خوکها علیه بیماری عفونی روتا ویروس خوکی از راه دهان (خوراندن روتاویروس گاوی) یا سویه واکسن لنتوژن (Lentogenic) در بیماری نیوکاسل طیور واکسینه را در مقابل سویه هاس حاد نیوکاسل (Velogenic) مصون و مقاوم می سازد.
