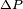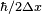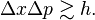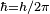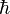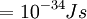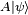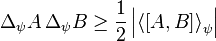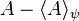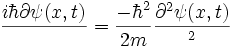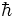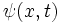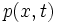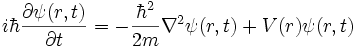دلایل ظهور مکانیک کوانتومی
بررسی ساختار اتمی به این نتیجه منجر میشود که رفتار الکترونها در اتم را نظیر
رفتار فوتونها ، نمیتوان با قوانین فیزیک کلاسیک یعنی قوانینی که در آزمایش با
اجسام ماکروسکوپی ثابت میشوند، توضیح داد.
وجود ترازهای انرژی گسسته در لایههای الکترونی اتم و قواعد حاکم بر انتقال بین
ترازها و پر شدن این حالتهای انرژی را نیز نمیتوان با بکارگیری مفاهیم قراردادی
مکانیک و قوانین الکترومغناطیس توجیه کرد.
نظریه دوبروی در مکانیک کوانتومی
قدم مهم در روشن شدن تناقضات بین مکانیک کلاسیک و مکانیک کوانتومی توسط
دوبروی فیزیکدان فرانسوی برداشته شد.ایشان کسی بود که این تفکر را که نه تنها
فوتونها بلکه تمام ذرات دارای خواص موجی هستند، پیشنهاد و اثبات کرد. این خواص
با قوانین کلاسیکی قابل بیان نیستند، ولی نقش مهمی در پدیدههای اتمی بازی
میکنند. معلوم شده است که کوانتوم تابش الکترومغناطیسی ، یعنی فوتونها ، با
اندازه حرکت P = E/C مشخص می شوند.
در ضمن موج نوری با فرکانس ν دارای طول موج λ = ν/Cλ = h/P در صورتی که خواص
فوتونها و سایر ذرات همان گونه که با فرضیه دوگانگی موج و ذره پیش بینی شد،
واقعا نظیر هم باشند.
این رابطه باید برای هر ذره کاربرد داشته باشد. به این طریق ، فرمول طول موج دوبروی
بدست آمد. طول موج دوبروی به ذره ای با اندازه حرکت P برای بیان خواص موجی آن
نسبت داده میشود. اگر سرعت ذره ای با جرم سکون m در مقایسه با سرعت نور
کم باشد، فرمول طول موج دوبروی را میتوان به صورت زیر نوشت:
است.با حذف فرکانس از این رابطهها ،رابطه بین طول موج و اندازه حرکت فوتون به
دست می آید.
بررسی ساختار اتمی به این نتیجه منجر میشود که رفتار الکترونها در اتم را نظیر
رفتار فوتونها ، نمیتوان با قوانین فیزیک کلاسیک یعنی قوانینی که در آزمایش با
اجسام ماکروسکوپی ثابت میشوند، توضیح داد.
وجود ترازهای انرژی گسسته در لایههای الکترونی اتم و قواعد حاکم بر انتقال بین
ترازها و پر شدن این حالتهای انرژی را نیز نمیتوان با بکارگیری مفاهیم قراردادی
مکانیک و قوانین الکترومغناطیس توجیه کرد.
نظریه دوبروی در مکانیک کوانتومی
قدم مهم در روشن شدن تناقضات بین مکانیک کلاسیک و مکانیک کوانتومی توسط
دوبروی فیزیکدان فرانسوی برداشته شد.ایشان کسی بود که این تفکر را که نه تنها
فوتونها بلکه تمام ذرات دارای خواص موجی هستند، پیشنهاد و اثبات کرد. این خواص
با قوانین کلاسیکی قابل بیان نیستند، ولی نقش مهمی در پدیدههای اتمی بازی
میکنند. معلوم شده است که کوانتوم تابش الکترومغناطیسی ، یعنی فوتونها ، با
اندازه حرکت P = E/C مشخص می شوند.
در ضمن موج نوری با فرکانس ν دارای طول موج λ = ν/Cλ = h/P در صورتی که خواص
فوتونها و سایر ذرات همان گونه که با فرضیه دوگانگی موج و ذره پیش بینی شد،
واقعا نظیر هم باشند.
این رابطه باید برای هر ذره کاربرد داشته باشد. به این طریق ، فرمول طول موج دوبروی
بدست آمد. طول موج دوبروی به ذره ای با اندازه حرکت P برای بیان خواص موجی آن
نسبت داده میشود. اگر سرعت ذره ای با جرم سکون m در مقایسه با سرعت نور
کم باشد، فرمول طول موج دوبروی را میتوان به صورت زیر نوشت:
است.با حذف فرکانس از این رابطهها ،رابطه بین طول موج و اندازه حرکت فوتون به
دست می آید.
λ = h/mv

مبنای تجربی دیدگاه موجی ذرات
اعتبار نظریه دوبروی با آزمایش پراکندگی الکترونی در بلورها تایید شد. قبلا ، شبیه
این آزمایش، آزمایش پراکندگی اشعه ایکس در بلورها برای اثبات ماهیت موجی اشعه
ایکس استفاده شده بود. بر اثر تداخل فیزیک امواج ثانویه گسیلی از اتمهای بلور که
آرایش منظم دارند، پراکندگی به جای تمام جهات فقط با زاویه معین نسبت به باریکه
تابشی روی میدهد.
علاوه بر نقطه مرکزی حاصل از باریکه مستقیم ، حلقههایی نیز از تابش پراکنده شده
(پراش یافته) روی فیلم عکاسی واقع در پشت بلور ، پراکنده میشود. معلوم شده
است که اگر بلور به جای اشعه ایکس با الکترونها بمباران شود، الکترونهای پراکنده
شده نیز روی فیلم عکاسی دسته حلقههایی همانند حلقههای ایجاد شده توسط
اشعه ایکس تشکیل میدهند. به این ترتیب میتوانیم بپذیریم که الکترونها تداخل
میکنند، یعنی دارای خواص موجی این آزمایشها بطور انکار ناپذیری ثابت کردند که
در بعضی از پدیدهها ، ریز ذرات همانند امواج رفتار میکنند. همچنین این آزمایشها
به دانشمندان امکان تعیین طول موجی را دادند که برای بیان پراش ذره باید به آن
نسبت داده شود.نتایج تجربی حاصل برای طول موج با مقدار حاصل از فرمول دوبروی
توافق کامل داشتند.
بنابرین ، معلوم گردید که طول موج با عکس حاصلضرب جرم ذره در سرعت آن mv
متناسب بوده و ضریب تناسب همان ثابت پلانک است.
ثابت پلانک بسیار کوچک h = 6.6 x 10-34 j.s است.
هستند. بعدها پدیدههای پراش برای سایر ذرات ، یعنی اتمها ، مولکولها و نوترونها
نیز مشاهده شد.
طول موج دوبروی وابسته به موج مادی چون ثابت پلانک بسیار کوچک است، به همین
علت طول موج دو بروی برای ذره ای با جرم محسوس ، خیلی کوچک و در حد قابل
اغماض است.
مطابق فرمول دوبروی ، یک ذره خاک با جرم حدود میکروگرم ( 9-10 کیلوگرم ) که با
سرعت 1Cm/s در حرکت است دارای طول موج λ = 6.6x10-34/(10-11)6.6x10-23 m
است.این مقدار حتی در مقایسه با ابعاد اتمی نیز تا حد قابل اغماض کوچک است. برای
اتمها و الکترونها با جرمی بسیار کوچکتر از میکروگرم وضعیت متفاوتی پیش میآید.
در سرعتهای معمولی، طول موج وابسته به آنها درحدود طول موج پرتوهای ایکس است.
برای مثال:
در مورد اتم هلیوم با انرژی 0.04 ev (انرژی حرکت گرمایی در اتاق) ، λ = 0.7x10-10 m
و برای الکترون با انرژی 13.5 ev طول موج دوبروی برابر λ = 3.3x10-10 m است.
با توجه به قوانین و مفاهیم نور شناسی نتیجه میگیریم، ماهیت موجی نور وقتی به
وضوح آشکار میشود که طول موجها با ابعاد اجسامی که نور با آنها اندرکنش میکند
قابل مقایسه باشد. برای مثال وقتی نور از روزنهای میگذرد که ابعاد آن چند برابر طول
موج است، یا وقتی از توری پراشی بازتابیده میشود که ثابت توری آن کوچک است،
از خواص موجی نور می توان صرف نظر کرد، زیرا عملا غیر قابل ملاحظهاند. همینطور
خواص موجی ذرات فقط وقتی مهمند که طول موج دوبروی در مقایسه با ابعاد اجسامی
که اندرکنش با آنها صورت میگیرد، کوچک نباشد. هنگام اندرکنش اتمها با الکترونها
یا با ریز ذرات دیگری که برای آنها طول موج دوبروی در حدود ابعاد اتمی است، خواص
موجی ذرات نقش مهم و گاهی تعیین کننده دارند.
هرگاه فرآیندها وابسته به رفتار الکترونها در اتمها یا مولکولها باشد، این نقش مهمتر
است.

زمینه ظهور مکانیک کوانتومی
وقتی که ذرات با ابعاد ماکروسکوپی اندرکنش میکنند، ذراتی که برای آنها طول
موج دوبروی تقریبا 9-10 برابر ابعاد آنهاست،خواص موجی نباید درنظر گرفته شود.
به همین علت مکانیک کلاسیک که قوانین آن از بررسیهای اجسام بزرگ بدست
میآید و خواص موجی اجسام هرگز به حساب نمیآید، نمیتواند پدیدههای مربوط
به این ذرات را بررسی نماید.
مکانیک کلاسیک در مسائل مربوط به حرکت اجرام آسمانی، قطعات ماشینها و ...
نتایج خوبی بدست میدهد.
اما درست به همین دلیل مکانیک کلاسیک برای توجیه پدیدههای اتمی کاملا نا
مناسب است.
مسائل مربوط به فیزیک اتمی را نمیتوان به کمک مکانیک نیوتونی حل کرد. بنابراین،
بایستی مکانیکی جدیدتر و کاملتری پیدا شود تا خواص موجی ماده را نیز به حساب
آورد. این مسئله مهم در اواخر سالهای بیست حل شد و در حل آن دانشمندان زیر
بیشترین سهم را داشتند و رمز کارل هایزنبرگ (1976-1901) فیزیکدان آلمانی، اروین
شرودینگر ( 1961- 1887 ) فیزیکدان اتریشی و پاول آدرین موریس دیراکقوانین حرکت
ذرات ماده ، که خواص موجی آنها را نیز به حساب می آورد به مکانیک کوانتومی یا
مکانیک موجی(1984-1902) فیزیکدان انگلیسی مجموعه معروف است.
حوزه عمل مکانیک کوانتومی
مکانیک کوانتومی تعداد زیادی از مسائل از جمله رفتار الکترونها در اتمها و مولکولها و
اندرکنش بین آنها که نشر و جذب نور را سبب میشوند و نیز برخورد الکترونها و سایر
ذرات با اتمهای مواد فرومغناطیس و بسیاری پدیدههای دیگر را شامل میشود. مکانیک
کوانتومی تعدادی پدیده تازه را نیز پیش بینی کرده است که تمام پیش بینیهای آن با
آزمایش تأیید شدهاند.
توضیح رضایت بخش از پدیدههای اتمی توسط مکانیک کوانتومی ثابت میکند که این
شاخه از فیزیک بازتاب صحیحی از قوانین واقعی طبیعت است.
میدان الکتریکی هسته ، الکترون را درون اتم در ناحیه معینی از فضا نزدیک هسته نگه
میدارد. با در نظر گرفتن الکترون به عنوان موج نمیتوانیم بطور دقیق حجمی را مشخص
کنیم که این موج در آن محبوس میشود همچنان که نمیتوانیم در لوله باز مرز مشخص
را نشان دهیم که آن طرف مرز ارتعاشها از بین میروند.
منظور ما از "ابعاد اتم" ابعاد ناحیه اصلی از اتم است که در آن موج الکترون یافت میشود.
مفاهیم موجی همساز در مورد رفتار الکترون در اتم را میتوان با استفاده از مکانیک
کوانتومی فرمولبندی کرد. محاسبات مکانیک کوانتومی عملا امکان تعیین حالتهای معین
اتم و تعیین ترازهای انرژی مربوط به این حالتها را فراهم میآورد. با اینکه قوانین مکانیک
کوانتومی با محاسبات حجیم و فرمولهای ریاضی نسبتاً پیچیدهای بیان میشوند. اما
جای نگرانی نیست، زیرا آنهایی که مکانیک کوانتومی را سخت میدانند و از آن هراس
دارند اصول بنیادی و مفاهیم آنرا درک نکردهاند.