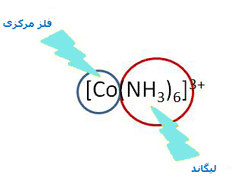
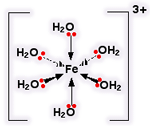
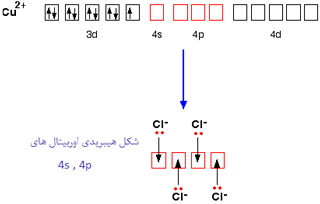
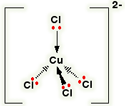
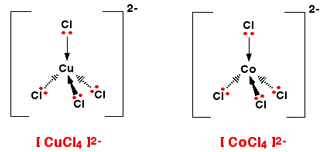
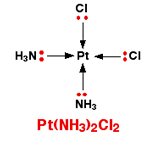
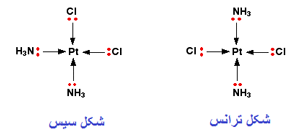
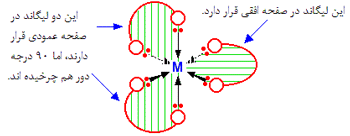
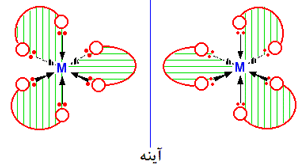
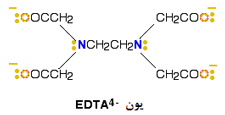
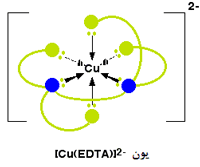
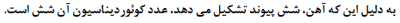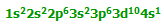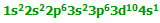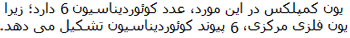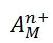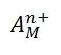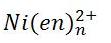یک کمپلکس مجموعه ای است متشکل از یک اتم مرکزی که توسط چند آنیون یا مولکول احاطه شده
و در آن ظرفیت اتم مرکزی که معمولا فلز واسطه است اکثرا از حالت متداول آن بیشتر است.
مثلا حل شدن سولفات مس خشک (سفیدرنگ) در آب محلول آبی خوشرنگ سولفات مس (II) تولید
می کند که یک یون کمپلکس است.
[SUP]-[/SUP] CuSO[SUB]4 [/SUB]+ nH[SUB]2 [/SUB]O ............> [Cu(H[SUB]2 [/SUB]O)[SUB]6 [/SUB]][SUP]2+ [/SUP]+ SO[SUB]4 [/SUB][SUP]2 [/SUP]
یون کمپلکس ایجاد شده عامل آبی شدن رنگ این محلول و درواقع تمام محلولهای نمکهای مس (II)
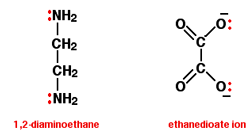
در آب می باشد.گروههای متصل به اتم مرکزی را که معمولا انیون یا مولکول دو قطبی خنثی میباشند
لیگاند می نامند و در اغلب موارد این لیگاندها یک یا چند جفت الکترون به فلز مرکزی می دهند. از
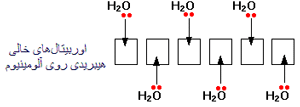
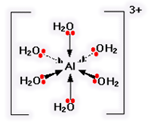
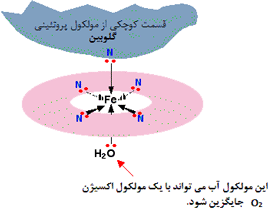
آنجاییکه مولکول آب قادر است مانند یک لیگاند عمل کند قرار گرفتن یک یون فلز واسطه ([SUP]+[/SUP]M[SUP]n [/SUP]) در
آب به شرط نبود گروه های کئوردینه ی دیگر سبب تشکیل یون کمپلکس[SUP]+[/SUP]M(H[SUB]2 [/SUB]O)[SUB]6 [/SUB]][SUP]n[/SUP]می شود.لذا
برای تهیه ی برخی از کمپلکس ها مثل [SUP]+[/SUP]Cu(NH[SUB]3 [/SUB])[SUB]6 [/SUB]][SUP]2[/SUP]واکنش بین فلز و لیگاند را باید در محیط غیر
آبی انجام دادتا آب به صورت لیگاند وارد قشر کوئوردیناسیون نشود.
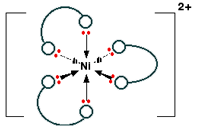
همچنین موقع تهیه ی کمپلکسها در آب لیگاند ها به تدریج جایگزین مولکولهای آب کئوردینه شده
می شوند مانند واکنش مقابل که در شش مرحله صورت می گیرد:
Ni(H[SUB]2 [/SUB]O)[SUB]6 [/SUB][SUP]2+ [/SUP]+ 6NH[SUB]3 [/SUB].............> Ni(NH[SUB]3 [/SUB])[SUB]6 [/SUB][SUP]2+[/SUP]
علاوه بر کمپلکس های عادی یا کلاسیک نوع دیگری از کمپلکس ها نیز وجود دارند که انها را ترکیبات
آلی فلزی می نامند در این کمپلکس ها حالت اکسایش فلز پایین (صفر یا +1 ) است و پیوند کربن
فلز هم وجود دارد. هم چنین در کمپلکس های کلاسیک لیگاند ها معمولا دهنده ی جفت الکترون
(دهنده ی ơ) و به مقدار جزئی گیرنده ی π هستند اما در ترکیبات آلی فلزی لیگاند ها اغلب علاوه
بر دهندگی الکترون گیرنده ی شدید π نیز می باشند.
در هر دو مورد این ترکیبات میتوانند خنثی کاتیونی یا انیونی باشند.از جمله کمپلکسهای آلی فلزی
فروسن است که شامل دو حلقه ی سیکلوپنتن در بالا وپایین اتم اهن است.
اولین ترکیب آلی فلزی جداسازی شده نمک زایس است که توسط زایس جداسازی شد. پایه گذار
شیمی کوئوردیناسیون مدرن آلفرد ورنر است او در سال 1866 در فرانسه متولد شد ورنر اولین مقاله
خود را درباره ی این موضوع در سال 1891 در سن 25 سالگی عرضه کرد و در سال 1913 جایزه ی
نوبل شیمی را برای این کار به وی اهدا شد.
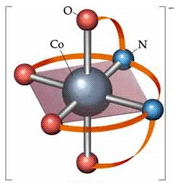
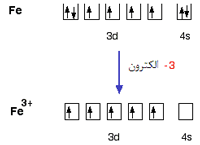
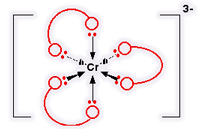
تعداد لیگاند ها و یا در واقع تعداد اتمهای دهنده الکترون متصل به فلز مرکزی را عدد کئودیناسیون
می گویند که یکی از ویژگی های یک کمپلکس است یعنی اینکه مثلا اغلب کمپلکسهای با عدد
کئوردینه یکسان خواص مغناطیسی مشابهی را از خود نشان می دهند.
خواص مغناطیسی کمپلکس های فلزی:
مغناطیس پذیری : اگر جسمی در یک میدان مغناطیسی با قدرت H[SUB]0 [/SUB]قرار گیرد القاء مغناطیسی B
یا شار مغناطیسی در این جسم از رابطه ی مقابل به دست می آید:
B= H[SUB]0 [/SUB]+ 4πM
در این رابطه H[SUB]0 [/SUB]قدرت میدان مغناطیسی خارجی و Mشدت مغناطیس شدن در واحد حجم است.
ممان مغناطیسی : خواص مغناطیسی ماده از دو راه توسط الکترونها حاصل می شود :
یکی ناشی از حرکت دورانی الکترون حول محور خود که چون دارای بار منفی است از این طریق
می تواند مغناطیس تولید کند (ممان اسپینی الکترون) و دیگری ناشی از حرکت الکترون در مدار
خود حول هسته (ممان اربیتالی الکترون).
پس ممان مغناطیسی تولیدی مواد حاصل این دو خاصیت الکترون است.واحد ممان مغناطیسی
بور مگنتون است یک بور مگنتون e ( BM)=eh̸ 4Πmc بار الکترون h ثابت پلانک m جرم الکترون
و c سرعت نور است.
ترکیب پارامغناطیس ترکیبی است که الکترون جفت نشده دارد سهم پارامغناطیسی در تاثیر
پذیری از بر هم کنش ممان های زاویه ای اسپینی و اربیتالی الکترونها با میدان مغناطیسی
خارجی ناشی می شود.
ممان مغناطیسی موثر برای یک سیستم پارامغناطیس با در نظرگرفتن ممانهای زاویه ای اسپینی
و اوربیتالی الکترونها از این رابطه به دست می آید:
( µ=√4S(S+1)+L(L+1
در این رابطه Sعدد کوانتومی اسپین کل و L عدد کوانتومی اوربیتالی کل است.همه ی مواد با
میدان مغناطیسی بر هم کنش دارند و بر اساس نوع بر هم کنش با میدان به چند دسته ی
زیر تقسیم می شوند:
دیا مغناطیس : خاصیت دیا مغناطیسی در همه ی انواع ماده دیده می شود و ناشی از حرکت
دورانی الکترونهای جفت شده ی مولکول در اثر القاء میدان مغناطیسی خارجی است. این
چرخش منجر به ایجاد یک میدان مغناطیسی کوچک مخالف میدان اعمال شده می شود و
به همین دلیل مواد دیامغناطیس از میدان مغناطیسی خارجی رانده می شوند.
پارامغناطیس :
خاصیت پارامغناطیسی از برهم کنش ممانهای زاویه ای اسپینی و اوربیتالی الکترونهای منفرد
با میدان مغناطیسی خارجی ناشی می شود.
این دسته از مواد جذب میدان می شوند و بر خلاف اجسام فرومغناطیس با از بین رفتن میدان
خارجی خاصیت مغناطیسی خود را از دست می دهند.
فرو مغناطیس : این دسته از مواد به شدت جذب میدان مغناطیسی می شوند در این دسته از
مواد ممانهای مغناطیسی ذرات مجاور با کمک میدان مغناطیسی خارجی به طور موازی جهت
گیری کرده و یک خاصیت مغناطیسی ماکروسکوپی را نشان می دهند یعنی اینکه در ماده فرو
مغناطیس حوزه های مغناطیسی وجود دارند که در هر کدام اسپینها به طور موازی جهتگیری
کرده اند در صورتی که با اعمال میدان خارجی اسپینهای همه ی حوزه ها با هم موازی میشوند
چنانچه دما از مقدار معینی بالاتر رود انرژی گرمایی جهت گیری حوزه ها را به صورت تصادفی
تغییر داده و ماده ی فرومغناطیس پارامغناطیس خواهد شد این دما به دمای کوری T[SUB]c [/SUB]معروف
است.
آنتی فرومغناطیس :
اگر در حوزه های مغناطیسی اسپینها به طور غیرموازی جهتگیری کرده باشند ممان مغناطیسی
حوزه ها یکدیگر را خنثی نموده و خاصیت آنتی فرومغناطیس مشاهده می شود افزایش دما
موجب برهم زدن جهت گیری های غیر موازی در حوزه ها و افزایش خاصیت مغناطیسی میشود
و بالاتر از یک دمای معین که به دمای نیل T[SUB]N [/SUB]معروف است جسم به صورت پارامغناطیس عمل
می کند. یک ماده ی انتی فرومغناطیس در دمای نیل بیشترین خاصیت مغناطیسی را از خود
نشان می دهد.