termah
مدیر بازنشسته
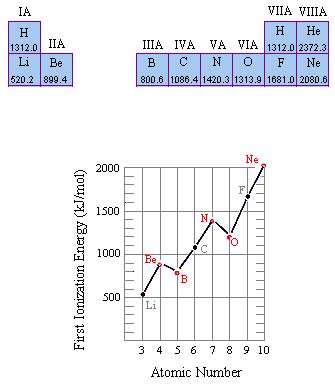
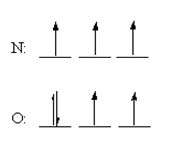
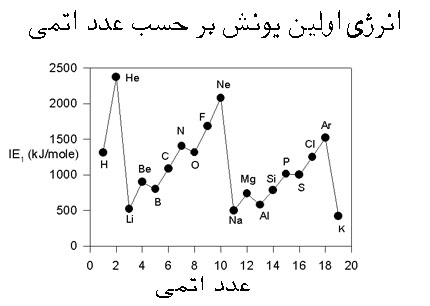
انرژی یونش
با اندکی مطالعه راجع به انرژی یونش و تشکیل یون های مختلف عناصر، متوجه می شوید که سدیم، منیزیم و آلومینیوم یون های Na[SUP]+[/SUP] و Mg[SUP]2+[/SUP] و Al[SUP]3+[/SUP] تشکیل می دهند. اما آیا تا کنون از خود پرسیده اید که چرا سدیم، یون های Na[SUP]2+[/SUP] یا حتی Na[SUP]3+[/SUP] تشکیل نمی دهد؟
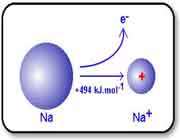
جواب این سؤال می تواند از انرژی دومین، سومین و ... یونش عناصر به دست آید. به عنوان مثال، انرژی اولین یونش سدیم، انرژی لازم برای برداشتن یک الکترون از یک اتم سدیم خنثی است:
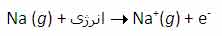 انرژی دومین یونش سدیم، انرژی لازم برای برداشتن یک الکترون دیگر از یون Na[SUP]+[/SUP] در حالت گازی است که یک یونNa[SUP]2+[/SUP]تشکیل می دهد:
انرژی دومین یونش سدیم، انرژی لازم برای برداشتن یک الکترون دیگر از یون Na[SUP]+[/SUP] در حالت گازی است که یک یونNa[SUP]2+[/SUP]تشکیل می دهد:
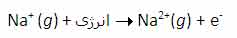 سومین انرژی یونش سدیم نیز به همین ترتیب است:
سومین انرژی یونش سدیم نیز به همین ترتیب است:
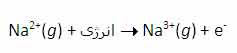 بنابراین انرژی لازم برای تشکیل یون Na[SUP]3+[/SUP] در فاز گازی، جمع انرژی های یونش اول، دوم و سوم این عنصر است.
بنابراین انرژی لازم برای تشکیل یون Na[SUP]3+[/SUP] در فاز گازی، جمع انرژی های یونش اول، دوم و سوم این عنصر است.
برای کندن یک الکترون از اتم سدیم و تشکیل یون Na[SUP]+[/SUP] با آرایش الکترونی لایه پر، انرژی چندان زیادی لازم نیست اما وقتی یک بار این اتفاق افتاد، برای برداشتن دومین الکترون از سدیم تقریباً باید 10 برابر انرژی یونش اولیه، انرژی صرف شود تا آرایش لایه پر Na[SUP]+[/SUP] شکسته شود و Na[SUP]2+[/SUP] تشکیل شود. به دلیل این که انرژی زیادی برای برداشتن دومین الکترون سدیم در هر واکنش شیمیایی لازم است، سدیم می تواند با عناصر دیگر طوری واکنش دهد که ترکیباتی شامل یون های Na[SUP]+[/SUP] تشکیل دهد نه یون های Na[SUP]2+[/SUP] یا Na[SUP]3+[/SUP].

با اندکی مطالعه راجع به انرژی یونش و تشکیل یون های مختلف عناصر، متوجه می شوید که سدیم، منیزیم و آلومینیوم یون های Na[SUP]+[/SUP] و Mg[SUP]2+[/SUP] و Al[SUP]3+[/SUP] تشکیل می دهند. اما آیا تا کنون از خود پرسیده اید که چرا سدیم، یون های Na[SUP]2+[/SUP] یا حتی Na[SUP]3+[/SUP] تشکیل نمی دهد؟
جواب این سؤال می تواند از انرژی دومین، سومین و ... یونش عناصر به دست آید. به عنوان مثال، انرژی اولین یونش سدیم، انرژی لازم برای برداشتن یک الکترون از یک اتم سدیم خنثی است:
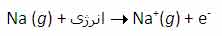
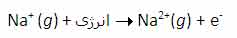
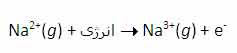
برای کندن یک الکترون از اتم سدیم و تشکیل یون Na[SUP]+[/SUP] با آرایش الکترونی لایه پر، انرژی چندان زیادی لازم نیست اما وقتی یک بار این اتفاق افتاد، برای برداشتن دومین الکترون از سدیم تقریباً باید 10 برابر انرژی یونش اولیه، انرژی صرف شود تا آرایش لایه پر Na[SUP]+[/SUP] شکسته شود و Na[SUP]2+[/SUP] تشکیل شود. به دلیل این که انرژی زیادی برای برداشتن دومین الکترون سدیم در هر واکنش شیمیایی لازم است، سدیم می تواند با عناصر دیگر طوری واکنش دهد که ترکیباتی شامل یون های Na[SUP]+[/SUP] تشکیل دهد نه یون های Na[SUP]2+[/SUP] یا Na[SUP]3+[/SUP].