You are using an out of date browser. It may not display this or other websites correctly.
You should upgrade or use an alternative browser.
You should upgrade or use an alternative browser.
آزمایشگاه شیمی معدنی
- شروع کننده موضوع S H i M A
- تاریخ شروع
گزارش کارهای آزمایشگاه شیمی معدنی 1 :
گزارش کار تهيه مس (I) كلريد از مس (II) كلريد
گزارش کار تهیه سدیم کرومات از سنگ معدن کرومیت
گزارش کار تعيين تعداد مولكول آب تبلور CuSO4
گزارش کار تهیه نمک مضاعف کوپر آمونیم یا آمونیم مس (III) سولفات هگزایدات
و کمپلکس تترا آمین مس (II) سولفات مونو هیدرات
گزارش کار تیتراسیون کمپلکسومتری مستقیم
گزارش کار تهيه زاج كروم
گزارش کار تهیه اسید بوریک از بوراکس
گزارش کار آزمایشگاه شیمی معدنی
گزارش کار آزمایشگاه شیمی معدنی
________________________________________
شیمی معدنی یک :
________________________________________
رنگدانه ها
تهیه یک نمک مضاعف و یک کمپلکس
تهیه بوتیک اسید از بوراکس و بررسی خواص آن
تهیه پر منگنات پتاسیم از سنگ معدن پیرولوزیت
تهیه پتاسیم متاپریدات و تعیین در صد خلوص آن
تهیه آب اکسیژنه
گزارش کار آزمایشگاه شیمی معدنی
________________________________________
شیمی معدنی یک :
________________________________________
رنگدانه ها
تهیه یک نمک مضاعف و یک کمپلکس
تهیه بوتیک اسید از بوراکس و بررسی خواص آن
تهیه پر منگنات پتاسیم از سنگ معدن پیرولوزیت
تهیه پتاسیم متاپریدات و تعیین در صد خلوص آن
تهیه آب اکسیژنه
رابطه نقطه جوش با فشار بخار ( آزمایش رامسی - یانگ )
رابطه نقطه جوش با فشار بخار ( آزمایش رامسی - یانگ )
رابطه نقطه جوش با فشار بخار ( آزمایش رامسی - یانگ )
یک جسم مایع ، در یک دمای مشخص و معین تغییر حالت پیدا کرده و تبخیر میشود. این دمای معین ، همان نقطه ی جوش جسم مایع است . تغییر حالت از مایع به بخار زمانی انجام میگیرد که فشار بخار مایع با فشار محیط برابر شود .
زمانی که فشار محیط بنا به هر دلیلی کاهش پیدا کند ، فشار بخار ماده سریعتر با فشار محیط برابر میشود ، یعنی زودتر به جوش می آید ، نهایتا نقطه ی جوش نیز پائین می آید . این تغییرات دمایی نسبت به تغییرات فشار توسط فردی بنام کلاپیرون بررسی شده است .
مزر مایع – بخار
برای یک ماده ف آنتروپی تبخیر در دمای T برابر H/T∆ است . بنابراین رابطه ی کلاپیرون برای مرز مایع – بخار عبارتند از :
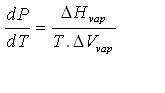
Hvap∆ مثبت است ، Vvap∆ بزرگ و مثبت است لذا dP/dTمثبت ولی بسیار کوچکتر از مقدار آن برای مزر جامد – مایع است . چون dT/dP بزرگ است ، از اینرو دمای جوش بسیار حساستر از دمای انجماد به فشار است .
از آنجا که حجم مولی گاز بسیار بزرگتر از حجم مولی مایع است بنابراین میتوان چنین نوشت :
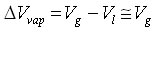
اگر گاز ( بخار ماده مورد نظر ) رفتار کامل داشته باشد میتوان رابطه ی کلاپیرون را چنین بازآرایی کرد :
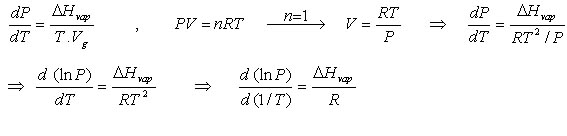
معادله ی فوق به معادله ی کلازیوس – کلاپیرون معروف است . این معادله امکان پیش بینی تغییرات فشار بخار با دما را به ما می دهد و نشان می دهد که چگونه دمای جوش با تغییر فشار تغییر می کند .
اگر آنتالپی تبخیر را مستقل از دما فرض کنیم ، می توانیم انتگرال فوق را به ترتیب زیر حل کنیم :
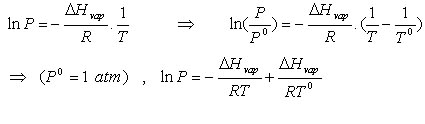
باید به این نکته توجه کرد که رابطه ی بدست آمده در محدوده ی دمایی و محدوده ی فشار معینی قابل استفاده است و در نقطه ی بحرانی و بالاتر از آن صدق نمیکند . به کمک این رابطه میتوان ، فشار بخار مایع را در نزدیکی دمای جوش معمولی آن به تقریب پیدا کرد . یعنی برای محاسبه Hvap∆ باید فشار هایی را اعمال کرد که نقاط جوش نزدیک به مقدار معمول بدست آید .
اگر تغییرات دما و فشار زیاد باشد نمیتوان از این رابطه استفاده کرد ، چون مقدار Hvap∆ نسبت به تغییر دما ، تغییر خواهد کرد.
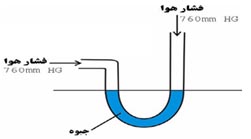
در روش رامسی – یانگ ، مقدار اندکی از مایع برای اجرای آزمایش کافی است و در فشار های مختلف که مانومتر آنرا نشان می دهد ، میتوان نقطه ی جوش را از روی ترمومتر قرائت کرد .
مانومتر دستگاه فشارسنج برای اندازه گیری فشار گازها است.
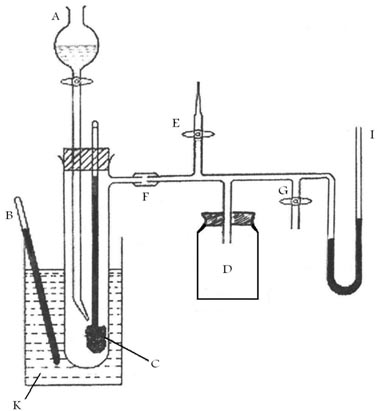
دستگاه رامسی – یانگ
این دستگاه از قسمت ها و بخش های مختلف تشکیل شده است که هر کدام نفش خاصی را در این آزمایش ایفا می کنند . این قسمت ها عبارتند از :
A= لوله متصل به قیف چکاننده که مایع مورد نظر در آن ریخته میشود
B = ترمومتر که در داخل حمام قرار دارد
C = ترمومتر که با پنبه یا پشم شیشه پوشیده شده
D = ظرف پایدار کننده فشار
E = دریچه ورود هوا جهت افزایش فشار سیستم
F = تله که درداخل بشرحاوی یخ و نمک قراردارد وجهت جمع آوری بخارات بکار میرود
G = پمپ خلا
I = مانومتر
K = حمام آب گرم
شرح آزمایش :
مایع مورد نظر را در محفظه ی قیف چکاننده ریخته و خلا را تا جایی اعمال می کنیم که فشار درون سیستم حدود cmHg 20 شود . شیر قیف را به آرامی باز کرده و آنرا طوری تنظیم می کنیم که تقریبا در هر 6 ثانیه یک قطره بچکد . جریان مایع باید طوری تنظیم شود که هر قطره ی ریخته شده قبل از ریختن قطره ی قبلی روی پنبه تبخیر شود.
مایع روی پنبه در اثر تراکم بخار گرم میشود و به دنبال تبخیر آن محیط سرد میشود تا جایی که تعادلی بین مایع و بخار برقرار شود . این دما ، دمای ثابتی است که باید آنرا یادداشت کنیم . این دما همان نقطه ی جوش جسم در فشار 20 cmHg می باشد . دریچه E باز می کنیم تا کمی هوا وارد سیستم شده و فشار آن تا حدود 30 cmHg افزایش یابد . دمای جوش را نیز در این فشار تعیین می کنیم . این عمل را برای فشار های 40،50،60 cmHg تکرار کرده و نقطه ی جوش را با استفاده از روابط و رسم نمودار بدست آورید.
رابطه نقطه جوش با فشار بخار ( آزمایش رامسی - یانگ )
رابطه نقطه جوش با فشار بخار ( آزمایش رامسی - یانگ )
یک جسم مایع ، در یک دمای مشخص و معین تغییر حالت پیدا کرده و تبخیر میشود. این دمای معین ، همان نقطه ی جوش جسم مایع است . تغییر حالت از مایع به بخار زمانی انجام میگیرد که فشار بخار مایع با فشار محیط برابر شود .
زمانی که فشار محیط بنا به هر دلیلی کاهش پیدا کند ، فشار بخار ماده سریعتر با فشار محیط برابر میشود ، یعنی زودتر به جوش می آید ، نهایتا نقطه ی جوش نیز پائین می آید . این تغییرات دمایی نسبت به تغییرات فشار توسط فردی بنام کلاپیرون بررسی شده است .
مزر مایع – بخار
برای یک ماده ف آنتروپی تبخیر در دمای T برابر H/T∆ است . بنابراین رابطه ی کلاپیرون برای مرز مایع – بخار عبارتند از :
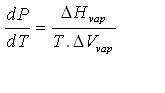
Hvap∆ مثبت است ، Vvap∆ بزرگ و مثبت است لذا dP/dTمثبت ولی بسیار کوچکتر از مقدار آن برای مزر جامد – مایع است . چون dT/dP بزرگ است ، از اینرو دمای جوش بسیار حساستر از دمای انجماد به فشار است .
از آنجا که حجم مولی گاز بسیار بزرگتر از حجم مولی مایع است بنابراین میتوان چنین نوشت :
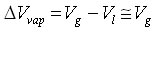
اگر گاز ( بخار ماده مورد نظر ) رفتار کامل داشته باشد میتوان رابطه ی کلاپیرون را چنین بازآرایی کرد :
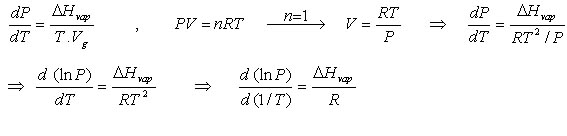
معادله ی فوق به معادله ی کلازیوس – کلاپیرون معروف است . این معادله امکان پیش بینی تغییرات فشار بخار با دما را به ما می دهد و نشان می دهد که چگونه دمای جوش با تغییر فشار تغییر می کند .
اگر آنتالپی تبخیر را مستقل از دما فرض کنیم ، می توانیم انتگرال فوق را به ترتیب زیر حل کنیم :
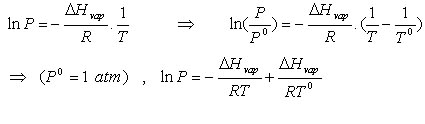
باید به این نکته توجه کرد که رابطه ی بدست آمده در محدوده ی دمایی و محدوده ی فشار معینی قابل استفاده است و در نقطه ی بحرانی و بالاتر از آن صدق نمیکند . به کمک این رابطه میتوان ، فشار بخار مایع را در نزدیکی دمای جوش معمولی آن به تقریب پیدا کرد . یعنی برای محاسبه Hvap∆ باید فشار هایی را اعمال کرد که نقاط جوش نزدیک به مقدار معمول بدست آید .
اگر تغییرات دما و فشار زیاد باشد نمیتوان از این رابطه استفاده کرد ، چون مقدار Hvap∆ نسبت به تغییر دما ، تغییر خواهد کرد.
در روش رامسی – یانگ ، مقدار اندکی از مایع برای اجرای آزمایش کافی است و در فشار های مختلف که مانومتر آنرا نشان می دهد ، میتوان نقطه ی جوش را از روی ترمومتر قرائت کرد .
مانومتر دستگاه فشارسنج برای اندازه گیری فشار گازها است.

دستگاه رامسی – یانگ
این دستگاه از قسمت ها و بخش های مختلف تشکیل شده است که هر کدام نفش خاصی را در این آزمایش ایفا می کنند . این قسمت ها عبارتند از :
A= لوله متصل به قیف چکاننده که مایع مورد نظر در آن ریخته میشود
B = ترمومتر که در داخل حمام قرار دارد
C = ترمومتر که با پنبه یا پشم شیشه پوشیده شده
D = ظرف پایدار کننده فشار
E = دریچه ورود هوا جهت افزایش فشار سیستم
F = تله که درداخل بشرحاوی یخ و نمک قراردارد وجهت جمع آوری بخارات بکار میرود
G = پمپ خلا
I = مانومتر
K = حمام آب گرم

شرح آزمایش :
مایع مورد نظر را در محفظه ی قیف چکاننده ریخته و خلا را تا جایی اعمال می کنیم که فشار درون سیستم حدود cmHg 20 شود . شیر قیف را به آرامی باز کرده و آنرا طوری تنظیم می کنیم که تقریبا در هر 6 ثانیه یک قطره بچکد . جریان مایع باید طوری تنظیم شود که هر قطره ی ریخته شده قبل از ریختن قطره ی قبلی روی پنبه تبخیر شود.
مایع روی پنبه در اثر تراکم بخار گرم میشود و به دنبال تبخیر آن محیط سرد میشود تا جایی که تعادلی بین مایع و بخار برقرار شود . این دما ، دمای ثابتی است که باید آنرا یادداشت کنیم . این دما همان نقطه ی جوش جسم در فشار 20 cmHg می باشد . دریچه E باز می کنیم تا کمی هوا وارد سیستم شده و فشار آن تا حدود 30 cmHg افزایش یابد . دمای جوش را نیز در این فشار تعیین می کنیم . این عمل را برای فشار های 40،50،60 cmHg تکرار کرده و نقطه ی جوش را با استفاده از روابط و رسم نمودار بدست آورید.
کروماتوگرافی کاغذی (paper chromatography)
کروماتوگرافی کاغذی (paper chromatography)
عنوان: کروماتوگرافی کاغذی (paper chromatography)
هدف: آشنایی با یک روش جداسازی، شناسایی و اندازه گیری مواد آلی
تئوری:
کروماتوگرافی کاغذی
انواع جداسازیهای مختلف و ساده بر روی کاغذ به عنوان پیشروان کروماتوگرافی کاغذی توصیف شدهاند. این سیستم معمولا به عنوان نمونه بارزی از سیستم تقسیمی در نظر گرفته میشود که در آن فاز ساکن آب است و به وسیله جذب سطحی بر روی مولکولهای سلولز قرار میگیرد و مولکولهای سلولز نیز به نوبه خود به وسیله ساختار الیافی کاغذ در وضعیتهای ثابت نگه داشته میشود. امروزه، به هر حال، مشخص شده است که جذب سطحی اجزای فاز متحرک و حل شوندهها و اثرات تبادل یون نیز نقشهایی را ایفا میکنند و کاغذ به هیچ عنوان تنها به صورت تکیهگاه بیاثر نیست.
سیر تحولی رشد
روش پیشنهادی رانگ در سال ۱۸۵۰ و فرآیندی که آن را تجزیه موئینهای مینامند، از جمله آنها میباشند. چنین روشهایی در واقع بیشتر شبیه کروماتوگرافی جذب سطحی بودند و کروماتوگرافی کاغذی به مفهوم فعلی، گسترش سیستم تقسیمی است که به وسیله مارتین و سینج در سال ۱۹۴۱ ارائه شد. در سال ۱۹۴۴ کونسدن، گوردن و مارتین اسیدهای آمینه و پپتیدهای موجود در محصول آبکافت، پروتئین پشم را به وسیله روشی جدا کردند که در آن به جای ستون پودر از یک صفحه یا نوار کاغذی آویزان در داخل یک ظرف سرپوشدار استفاده شده بود.
کاربرد
در ابتدا کروماتوگرافی کاغذی برای جداسازی مخلوطهای مواد آلی به کار رفت. ولی بعد از آن، عمدتا به وسیله برستال و پولارد و همکاران آنها، برای جداسازی یونهای معدنی به سرعت به کار گرفته شد. هم آنیونها و هم کاتیونها را به وسیله این روش میتوان جدا کرد.
خصوصیت ویژه
یک خصوصیت ویژه روش کروماتوگرافی کاغذی این است که چیزی مربوط به محلول یا گاز خارج شده از ستون که در سیستمهای معمول مایع یا گاز با آن برخورد میکنیم وجود ندارد. ترکیبات جدا شده روی کاغذ مکانیابی و شناسایی میشوند در نتیجه، جداسازی به طور نسبتا دائم در روی کاغذ ثبت میشود. در این روش اجزای جدا شده جمع آوری نمیشوند و احتیاجی به وسایل پیچیده کنترل پیوسته نیست. اندازه گیری کمی ترکیبات جدا شده را میتوان روی کاغذ انجام داد ولی اگر بخواهند اجرای را از کاغذ خارج کنند. تنها کار لازم این است که قسمت مربوط به هر یک از اجسام را از کاغذ ببرند و هر یک را به طور جداگانه بشویند.
طرح کلی روش
قطرهای از محلولحاوی مخلوطی که باید جدا شود را روی یک صفحه یا نوار کاغذ صافی در محل علامت گذاری شده قرار میدهند. در این محل، قطره به صورت یک لکه حلقوی پخش میشود. وقتی که لکه خشک شده کاغذ را در یک ظرف مناسب سربسته طوری قرار دهند که یک سر آن در حلال انتخاب شده به عنوان فاز متحرک فرو رود. حلال از طریق الیاف کاغذ در نتیجه عمل موئینگی نفوذ میکند و نکته مهم این است که سطح کاغذ نباید کاملا به وسیله حلال پوشانده شود. زیرا در این صورت، اصلا جدا سازی صورت نمیگیرد یا نواحی خیلی پخش میشوند.
وقتی که جبهه حلال مسافت مناسبی را طی کرد یا بعد از یک زمان از قبل تعیین شده، کاغذ را از طرف بیرون آورده، جبهه حلال را با علامتی مشخص میکنند و میگذارند تا صفحه خشک شود. وقتی که محلهای مناطق جدا شده آشکار شدند لازم است که هر یک از اجسام به طور جداگانه شناسایی شوند. در موارد ایدهآل، هر جسم با واکنشگر مکانیاب، رنگ مخصوصی میدهد که در مورد مواد معدنی بیشتر و درمورد مواد آلی کمتر مشاهده میشود. سادهترین روش شناسایی بر اساس مقدار Rf یعنی نسبت فاصله طی شده به وسیله جبهه حلال است.
خارج کردن جسم از کاغذ
روشهای ارائه شده مستلزم به کارگیری یک واکنشگر مکان یاب شیمیایی برای تعیین محل لکه هستند، و لکههای رنگی اساس ارزیابی را تشکیل میدهند. بعضی اوقات میتوان کمپلکس را شستشو داد و به وسیله روش رنگ سنجی تخمین زد، ولی اگر تغییر شیمیایی قابل قبول نباشد ماده تغییر نیافته را باید شستشو داد. عمل شستشو را میتوان با وارد کردن تکه کاغذ در یک حلال، به وسیله استخراج در یک دستگاه سوکسیله، یا با استفاده از آرایش خاصی، که در کاغذ یک جریان نزولی کروماتوگرافی ایجاد مینماید، انجام داد. برای جداسازیهای معدنی تکههای کاغذ را میتوان به صورت خاکستر در آورده، باقیماندهها را در اسید حل کرد. نتایج این روش به اندازه روش شستشو خوب نیستند. از اینرو محلولهای به دست آمده را میتوان به وسیله هر روش مناسبی تجزیه کرد، روشهایی که اغلب به دنبال روشهای کروماتوگرافی به کار میروند عبارتند از رنگ سنجی و قطبش نگاری.
پیدا کردن یک روش کروماتوگرافی، که بتواند به طور کمی تمامی اجزای یک مخلوط را جدا کند، مطلقا ضروری نیست. ارزیابی کمی فلزات با قطبش نگاری و ارزیابی کمی مواد آلی مشکلتر از فلزات است زیرا، برای مواد آلی، روشهای موجود برای آزمایش محلول حاصل از شستشو محدودتر هستند. ارزیابی مواد آلی معمولا بر روی کاغذ صورت میگیرند و بنابراین، لازم است که هر جسمی از اجسام دیگر به طور کمی جدا شود.
نقایص کروماتوگرافی کاغذی
لکههای چند تایی:
در کروماتوگرافی یونها فلزی، اگر دارای آنیونی متفاوت از آنیون موجود در محلول اولیه باشد، ممکن است رقابتی بین آنیونها برای یون فلزی وجود داشته باشد، که در نتیجه دو لکه به دست میآید که هر یک از آنها مربوط به یکی از نمکهای فلزی میباشد. ممکن است یون فلزی دو کمپلکس متفاوت با حلال ایجاد کند. در جدا سازیهای آلی، ممکن است جسم دو شکل متفاوت وجود داشته باشد. به عنوان مثال یک آمینو اسید میتواند به صورت کاتیون و یون دو قطبی باشد.
دنباله دار شدن:
اگر مخلوط یه مقدار زیاد از حد روی کاغذ قرار داده شود، یا سرعت عبور حلال متفاوت باشد، جسم نمیتواند برای ایجاد یک لکه مجزا به تعادل برسد. در این صورت این لکه، در سطح بزرگی از کاغذ پخش شده و از حلال در حال پیشروی عقب میماند. دنبالهدار شدن ممکن است به سبب اثرات جذبی سطحیتر ایجاد شود.
اثرات لبه یا کناره:
لکهها خیلی نزدیک به کنار نوار، ممکن است در امتداد کنار کاغذ پخش شوند، عمل نفوذ ممکن است به علت بالا بودن غلظت موضعی فاز متحرک در آن ناحیه، و یا به علت بالاتر بودن سرعت تبخیر حلال در کنار کاغذ، که منجر به اثرات تقسیمی غیرعادی میشوند، باشد.
روش کمی کروماتوگرافی کاغذی
کاربرد کمی این روش نه تنها احتیاج به یک جداسازی کمی، بلکه مکانیابی و ارزیابی کمی اجسام موجود نیز دارد. یک جداسازی کیفی رضایت بخش، الزاما برای کار کمی مفید نیست. اندازه گیری کمی را میتوان یا با سنجش مقدار جسم موجود در لکه روی کاغذ، یا با خارج کردن جسم از کاغذ و تجزیه اجزای جدا شده به وسیله روشهای کمی متداول انجام داد. لکه اولیه از نمونه مناسب روی کاغذ قرار میدهند، خشک کردن لکه باید تحت شرایط استاندارد زمان و دما صورت گیرد.
در تهیه حلال باید دقت زیادی روی نسبتهای اجزای صورت گیرد، برقرار ساختن تعادل باید به طور استاندارد انجام گیرد، طول عبور حلال در تمامی نوبتها یکسان باشد، در طول آزمایش، دما باید ثابت بماند، و خشک کردن ورقه باید در یک زمان و دمای استاندارد انجام گیرد. واکنشگر مکانیاب (در صورت استفاده از لکههای رنگی) باید به طریق کاملا تکرارپذیر افزوده شود. و هر عمل بعدی، مانند خشک کردن یا قراردادن در معرض بخار آمونیاک، باید در مدت استاندارد انجام گیرد. مقدار جسمی که در یک جداسازی کروماتوگرافی باید روی کاغذ قرار گیرد، متغیر است.
مواد لازم: متیل رد، متیل اورانژ، مجهول A، مجهول B، اتانول
وسایل لازم: بشر، لوله موئین، کاغذ صافی یا کروماتوگرافی، خط کش و مداد، منگنه، شیشه ساعت
روش آزمایش:
ابتدا یک کاغذ صافی را در اندازهٔ ۲۰X۱۲ را بریده و در فاصلهٔ ۲ سانتی متری خط میکشیم و نقطههایی را به فاصلهٔ ۳ سانتی متری از هم بر روی این خط علامتگذاری میکنیم. سپس بالای کاغذ را به فاصلهٔ ۱ سانتی متر خط میکشیم.
حال با لولهٔ موئین به ترتیب یک نقطه از محلولها را بر روی کاغذ صافی قرار میدهیم و کاغذ را لوله کرده و انتهای آن را با منگنه به هم وصل میکنیم و درون یک بشر که کف آن با ۱۵ میلی لیتر اتانول پر شده است میگذاریم و یک عدد شیشه ساعت را بر روی آن قرار میدهیم.
با بالا آمدن الکل لکهها شروع به بالا رفتن میکنند. پس از آنکه حلال به خط بالایی کاغذ رسید، آنرا بیرون آورده و خشک میکنیم.
محاسبات:
R. f= (ماده توسط شده طی مسافت) / (حلال برای شده طی مسافت)
موارد خطا:
اگر مخلوط یه مقدار زیاد از حد روی کاغذ قرار داده شود، یا سرعت عبور حلال متفاوت باشد، جسم نمیتواند برای ایجاد یک لکه مجزا به تعادل برسد. در این صورت این لکه، در سطح بزرگی از کاغذ پخش شده و از حلال در حال پیشروی عقب میماند.
لکهها خیلی نزدیک به کنار نوار، ممکن است در امتداد کنار کاغذ پخش شوند
نتیجه گیری:
کروماتوگرافی کاغذی اکثرا به عنوان یک وسیله تحقیقاتی به کار میرود، و به طور گستردهای در تجزیههای روزمره مخصوصا در جداسازیهای جدیدی که هیچ روش کلاسیک برای آنها وجود ندارد، نیز مورد استفاده قرار میگیرد. روش اخیر در مسائل کلینیکی و زیست شیمیایی، جداسازی اسیدهای آمینه و پپتیدها در بررسی ساختارهای پروتئین کاربرد دارد.
لینک دانلود
کروماتوگرافی کاغذی (paper chromatography)
عنوان: کروماتوگرافی کاغذی (paper chromatography)
هدف: آشنایی با یک روش جداسازی، شناسایی و اندازه گیری مواد آلی
تئوری:
کروماتوگرافی کاغذی
انواع جداسازیهای مختلف و ساده بر روی کاغذ به عنوان پیشروان کروماتوگرافی کاغذی توصیف شدهاند. این سیستم معمولا به عنوان نمونه بارزی از سیستم تقسیمی در نظر گرفته میشود که در آن فاز ساکن آب است و به وسیله جذب سطحی بر روی مولکولهای سلولز قرار میگیرد و مولکولهای سلولز نیز به نوبه خود به وسیله ساختار الیافی کاغذ در وضعیتهای ثابت نگه داشته میشود. امروزه، به هر حال، مشخص شده است که جذب سطحی اجزای فاز متحرک و حل شوندهها و اثرات تبادل یون نیز نقشهایی را ایفا میکنند و کاغذ به هیچ عنوان تنها به صورت تکیهگاه بیاثر نیست.
سیر تحولی رشد
روش پیشنهادی رانگ در سال ۱۸۵۰ و فرآیندی که آن را تجزیه موئینهای مینامند، از جمله آنها میباشند. چنین روشهایی در واقع بیشتر شبیه کروماتوگرافی جذب سطحی بودند و کروماتوگرافی کاغذی به مفهوم فعلی، گسترش سیستم تقسیمی است که به وسیله مارتین و سینج در سال ۱۹۴۱ ارائه شد. در سال ۱۹۴۴ کونسدن، گوردن و مارتین اسیدهای آمینه و پپتیدهای موجود در محصول آبکافت، پروتئین پشم را به وسیله روشی جدا کردند که در آن به جای ستون پودر از یک صفحه یا نوار کاغذی آویزان در داخل یک ظرف سرپوشدار استفاده شده بود.
کاربرد
در ابتدا کروماتوگرافی کاغذی برای جداسازی مخلوطهای مواد آلی به کار رفت. ولی بعد از آن، عمدتا به وسیله برستال و پولارد و همکاران آنها، برای جداسازی یونهای معدنی به سرعت به کار گرفته شد. هم آنیونها و هم کاتیونها را به وسیله این روش میتوان جدا کرد.
خصوصیت ویژه
یک خصوصیت ویژه روش کروماتوگرافی کاغذی این است که چیزی مربوط به محلول یا گاز خارج شده از ستون که در سیستمهای معمول مایع یا گاز با آن برخورد میکنیم وجود ندارد. ترکیبات جدا شده روی کاغذ مکانیابی و شناسایی میشوند در نتیجه، جداسازی به طور نسبتا دائم در روی کاغذ ثبت میشود. در این روش اجزای جدا شده جمع آوری نمیشوند و احتیاجی به وسایل پیچیده کنترل پیوسته نیست. اندازه گیری کمی ترکیبات جدا شده را میتوان روی کاغذ انجام داد ولی اگر بخواهند اجرای را از کاغذ خارج کنند. تنها کار لازم این است که قسمت مربوط به هر یک از اجسام را از کاغذ ببرند و هر یک را به طور جداگانه بشویند.
طرح کلی روش
قطرهای از محلولحاوی مخلوطی که باید جدا شود را روی یک صفحه یا نوار کاغذ صافی در محل علامت گذاری شده قرار میدهند. در این محل، قطره به صورت یک لکه حلقوی پخش میشود. وقتی که لکه خشک شده کاغذ را در یک ظرف مناسب سربسته طوری قرار دهند که یک سر آن در حلال انتخاب شده به عنوان فاز متحرک فرو رود. حلال از طریق الیاف کاغذ در نتیجه عمل موئینگی نفوذ میکند و نکته مهم این است که سطح کاغذ نباید کاملا به وسیله حلال پوشانده شود. زیرا در این صورت، اصلا جدا سازی صورت نمیگیرد یا نواحی خیلی پخش میشوند.
وقتی که جبهه حلال مسافت مناسبی را طی کرد یا بعد از یک زمان از قبل تعیین شده، کاغذ را از طرف بیرون آورده، جبهه حلال را با علامتی مشخص میکنند و میگذارند تا صفحه خشک شود. وقتی که محلهای مناطق جدا شده آشکار شدند لازم است که هر یک از اجسام به طور جداگانه شناسایی شوند. در موارد ایدهآل، هر جسم با واکنشگر مکانیاب، رنگ مخصوصی میدهد که در مورد مواد معدنی بیشتر و درمورد مواد آلی کمتر مشاهده میشود. سادهترین روش شناسایی بر اساس مقدار Rf یعنی نسبت فاصله طی شده به وسیله جبهه حلال است.
خارج کردن جسم از کاغذ
روشهای ارائه شده مستلزم به کارگیری یک واکنشگر مکان یاب شیمیایی برای تعیین محل لکه هستند، و لکههای رنگی اساس ارزیابی را تشکیل میدهند. بعضی اوقات میتوان کمپلکس را شستشو داد و به وسیله روش رنگ سنجی تخمین زد، ولی اگر تغییر شیمیایی قابل قبول نباشد ماده تغییر نیافته را باید شستشو داد. عمل شستشو را میتوان با وارد کردن تکه کاغذ در یک حلال، به وسیله استخراج در یک دستگاه سوکسیله، یا با استفاده از آرایش خاصی، که در کاغذ یک جریان نزولی کروماتوگرافی ایجاد مینماید، انجام داد. برای جداسازیهای معدنی تکههای کاغذ را میتوان به صورت خاکستر در آورده، باقیماندهها را در اسید حل کرد. نتایج این روش به اندازه روش شستشو خوب نیستند. از اینرو محلولهای به دست آمده را میتوان به وسیله هر روش مناسبی تجزیه کرد، روشهایی که اغلب به دنبال روشهای کروماتوگرافی به کار میروند عبارتند از رنگ سنجی و قطبش نگاری.
پیدا کردن یک روش کروماتوگرافی، که بتواند به طور کمی تمامی اجزای یک مخلوط را جدا کند، مطلقا ضروری نیست. ارزیابی کمی فلزات با قطبش نگاری و ارزیابی کمی مواد آلی مشکلتر از فلزات است زیرا، برای مواد آلی، روشهای موجود برای آزمایش محلول حاصل از شستشو محدودتر هستند. ارزیابی مواد آلی معمولا بر روی کاغذ صورت میگیرند و بنابراین، لازم است که هر جسمی از اجسام دیگر به طور کمی جدا شود.
نقایص کروماتوگرافی کاغذی
لکههای چند تایی:
در کروماتوگرافی یونها فلزی، اگر دارای آنیونی متفاوت از آنیون موجود در محلول اولیه باشد، ممکن است رقابتی بین آنیونها برای یون فلزی وجود داشته باشد، که در نتیجه دو لکه به دست میآید که هر یک از آنها مربوط به یکی از نمکهای فلزی میباشد. ممکن است یون فلزی دو کمپلکس متفاوت با حلال ایجاد کند. در جدا سازیهای آلی، ممکن است جسم دو شکل متفاوت وجود داشته باشد. به عنوان مثال یک آمینو اسید میتواند به صورت کاتیون و یون دو قطبی باشد.
دنباله دار شدن:
اگر مخلوط یه مقدار زیاد از حد روی کاغذ قرار داده شود، یا سرعت عبور حلال متفاوت باشد، جسم نمیتواند برای ایجاد یک لکه مجزا به تعادل برسد. در این صورت این لکه، در سطح بزرگی از کاغذ پخش شده و از حلال در حال پیشروی عقب میماند. دنبالهدار شدن ممکن است به سبب اثرات جذبی سطحیتر ایجاد شود.
اثرات لبه یا کناره:
لکهها خیلی نزدیک به کنار نوار، ممکن است در امتداد کنار کاغذ پخش شوند، عمل نفوذ ممکن است به علت بالا بودن غلظت موضعی فاز متحرک در آن ناحیه، و یا به علت بالاتر بودن سرعت تبخیر حلال در کنار کاغذ، که منجر به اثرات تقسیمی غیرعادی میشوند، باشد.
روش کمی کروماتوگرافی کاغذی
کاربرد کمی این روش نه تنها احتیاج به یک جداسازی کمی، بلکه مکانیابی و ارزیابی کمی اجسام موجود نیز دارد. یک جداسازی کیفی رضایت بخش، الزاما برای کار کمی مفید نیست. اندازه گیری کمی را میتوان یا با سنجش مقدار جسم موجود در لکه روی کاغذ، یا با خارج کردن جسم از کاغذ و تجزیه اجزای جدا شده به وسیله روشهای کمی متداول انجام داد. لکه اولیه از نمونه مناسب روی کاغذ قرار میدهند، خشک کردن لکه باید تحت شرایط استاندارد زمان و دما صورت گیرد.
در تهیه حلال باید دقت زیادی روی نسبتهای اجزای صورت گیرد، برقرار ساختن تعادل باید به طور استاندارد انجام گیرد، طول عبور حلال در تمامی نوبتها یکسان باشد، در طول آزمایش، دما باید ثابت بماند، و خشک کردن ورقه باید در یک زمان و دمای استاندارد انجام گیرد. واکنشگر مکانیاب (در صورت استفاده از لکههای رنگی) باید به طریق کاملا تکرارپذیر افزوده شود. و هر عمل بعدی، مانند خشک کردن یا قراردادن در معرض بخار آمونیاک، باید در مدت استاندارد انجام گیرد. مقدار جسمی که در یک جداسازی کروماتوگرافی باید روی کاغذ قرار گیرد، متغیر است.
مواد لازم: متیل رد، متیل اورانژ، مجهول A، مجهول B، اتانول
وسایل لازم: بشر، لوله موئین، کاغذ صافی یا کروماتوگرافی، خط کش و مداد، منگنه، شیشه ساعت
روش آزمایش:
ابتدا یک کاغذ صافی را در اندازهٔ ۲۰X۱۲ را بریده و در فاصلهٔ ۲ سانتی متری خط میکشیم و نقطههایی را به فاصلهٔ ۳ سانتی متری از هم بر روی این خط علامتگذاری میکنیم. سپس بالای کاغذ را به فاصلهٔ ۱ سانتی متر خط میکشیم.
حال با لولهٔ موئین به ترتیب یک نقطه از محلولها را بر روی کاغذ صافی قرار میدهیم و کاغذ را لوله کرده و انتهای آن را با منگنه به هم وصل میکنیم و درون یک بشر که کف آن با ۱۵ میلی لیتر اتانول پر شده است میگذاریم و یک عدد شیشه ساعت را بر روی آن قرار میدهیم.
با بالا آمدن الکل لکهها شروع به بالا رفتن میکنند. پس از آنکه حلال به خط بالایی کاغذ رسید، آنرا بیرون آورده و خشک میکنیم.
محاسبات:
R. f= (ماده توسط شده طی مسافت) / (حلال برای شده طی مسافت)
موارد خطا:
اگر مخلوط یه مقدار زیاد از حد روی کاغذ قرار داده شود، یا سرعت عبور حلال متفاوت باشد، جسم نمیتواند برای ایجاد یک لکه مجزا به تعادل برسد. در این صورت این لکه، در سطح بزرگی از کاغذ پخش شده و از حلال در حال پیشروی عقب میماند.
لکهها خیلی نزدیک به کنار نوار، ممکن است در امتداد کنار کاغذ پخش شوند
نتیجه گیری:
کروماتوگرافی کاغذی اکثرا به عنوان یک وسیله تحقیقاتی به کار میرود، و به طور گستردهای در تجزیههای روزمره مخصوصا در جداسازیهای جدیدی که هیچ روش کلاسیک برای آنها وجود ندارد، نیز مورد استفاده قرار میگیرد. روش اخیر در مسائل کلینیکی و زیست شیمیایی، جداسازی اسیدهای آمینه و پپتیدها در بررسی ساختارهای پروتئین کاربرد دارد.
لینک دانلود
رسوب گیری
رسوب گیری
وزن سنجی یک نمونه به روش رسوبگیری
این روش برای موادی که ترکیب شیمیایی آنها معین است، بکار میرود. در این روش، نمونه مورد نظر را از بقیه اجزا به صورت رسوبی که ترکیب شیمیایی آن معلوم است جدا کرده، پس از خشک و وزن کردن با ترازوی حساس، درصد وزنی آن را حساب میکنیم.
شرایط تهیه یک رسوب مناسب چیست؟
استوکیومتری
واکنشگر رسوب دهنده و جسم مورد نظر به نسبت وزنی معین و طبق فرمول شیمیایی با هم ترکیب میشوند، به عبارت دیگر واکنش آنها باید کمی باشد.
پایدار بودن
وزن رسوب در شرایط آزمایش باید ثابت بماند. مثلا نباید فرار یا قابل تجزیه بوده، قابلیت ترکیب با اجزای موجود در هوا و یا جذب آنها را داشته باشد.
خالص بودن و خوب صاف شدن
رسوبهای کلوئیدی که به سختی صاف میشوند، برای وزن سنجی مناسب نیستند.
انواع رسوبها از لحاظ فیزیکی
وضع فیزیکی رسوبها به اندازه، شکل و بار الکتریکی ذرات بستگی دارد.
رسوبهای بلوری
رسوبهای بلوری، درشت بوده، برای صاف کردن مناسب هستند. بنابراین بهترین رسوب برای وزن سنجی هستند. مانند
رسوبهای لختهای
رسوبهای لختهای مانند رسوب که شبیه شیر منعقد شده بوده، ذرات ریز بهم چسبیده و ذرات درشتتری ایجاد میکنند و در اثر شستشو با آب (عمل والختی)، دوباره به ذرات ریز تبدیل میشوند.
رسوبهای ژلاتینی
مانند فریک هیدروکسید هستند. قطر ذرات این رسوبها خیلی کوچک است، بنابراین از صافی رد میشوند و بعضی از آنها نیز سوراخهای صافی را مسدود کرده، باعث کندی عمل صاف کردن میشوند.
فرایند تشکیل رسوب
تشکیل رسوب، هم یک پدیده شیمیایی و هم یک پدیده فیزیکی است. پدیده شیمیایی تشکیل رسوب شامل واکنش شیمیایی واکنشگر و نمونه مورد نظر است. پدیده فیزیکی، شامل هستهزایی و رشد بلور (دو مرحله) است.
هستهزایی
تشکیل اولیه ذرات کوچک فاز جامد در فاز مایع را که از رسوب مورد نظر به حالت اشباع رسیده باشد، هستهزایی مینامند.
رشد بلور
رسوب کردن یونهای محلول روی ذرات اولیه را که سبب درشت شدن رسوبها میشود، رشد بلور مینامند.
ناخالصیهای موجود در رسوب
ناخالصیهای همرسوبی و انواع آن
همراهی مواد ناخالص محلول با رسوب تشکیل شده را همرسوبی مینامند و انواع آن عبارتند از:
• جذب سطحی:
در این حالت، ناخالصی فقط در سطح رسوب جذب میشود. مانند جذب سطحی یونهای نقره توسط رسوب کلرید نقره. رسوبهای کلوئیدی به دلیل جاذبه الکتریکی بارهای مخالف، بیشتر خاصیت جذب سطحی دارند.
• احتباس:
در این حالت، ناخالصیها در داخل رسوب هستند، یعنی فاز رسوب در حین تشکیل، مقداری از مواد ناخالص یا محلول اولیه را در بین ملکولهای خود به دام میاندازد. حتی با شستشو هم نمیتوان آنها را از هم جدا کرد.
• در برگیری:
در این روش، ناخالصیهایی که سیستم و ساختمان بلوری آنها با رسوب یکی است، همراه با ذرات رسوب، متبلور میشوند.
ناخالصیهای پس رسوب
در این حالت، پس از تشکیل رسوب، ترکیب دیگری که در شرایط آزمایش کم محلول است، رسوب کرده، لایهای از ناخالصیها روی رسوب اولیه را میپوشاند. به عنوان مثال در جدا کردن کلسیم از منیزیم توسط رسوب دادن با یون اکسالات، رسوب کلسیم اکسالات به آرامی تشکیل میشود. اگر محلول، مدتی بیش از اندازه لازم بماند، مقدار کمی منیزیم اکسالات روی کلسیم اکسالات رسوب میکند.
نکات مهم در رسوب گیری
• محلول جسم مجهول باید رقیق باشد و عامل رسوب دهنده قطره قطره به آن اضافه شود و همراه با همزدن محلول باشد. در این صورت تشکیل رسوب به آرامی صورت خواهد گرفت و احتباس کمترین مقدار را خواهد داشت.
• رسوب تشکیل شده را قبل از صاف کردن باید در حدود ده دقیقه روی حمام بخار آب، گرما داد. با این عمل ذرات ریزتر به علت حلالیت بیشتر دوباره حل شده، روی ذرات درشتتر رسوب میکنند. در نتیجه ذرات رسوب، درشتتر شده، سبب تقلیل جذب مواد خارجی بوسیله رسوب میشود.
حلالیت و حاصلضرب حلالیت یک رسوب
حلالیت رسوبها کم بوده، رفتار آنها در آب مانند الکترولیتها است، یعنی وقتی رسوب AB که دارای یک یون فلزی و یک آنیون یک ظرفیتی است، در آب تشکیل میشود. محلول از یونهای A و B اشباع میشود. مقدار رسوب حل شده را برحسب واحد مول در لیتر بیان میکنند و حاصلضرب غلظتهای A و B را حاصلضرب حلالیت رسوب () مینامند.
عوامل موثر بر حلالیت
• اثر یون مشترک:
افزایش یک الکترولیت که دارای یک یون مشترک با رسوب است، سبب کم شدن حلالیت میشود.
• اثر PH محیط:
اگر به رسوبی که نمک یک اسید ضعیف است، یک اسید قویتر اضافه کنیم، مقداری از رسوب حل میشود. تشکیل هر رسوب باید در PH مناسب آن صورت گیرد. با کنترل PH یک محلول که شامل چند کاتیون است، میتوان آنها را به صورت رسوب هیدروکسید جدا کرد.
• اثر حلال:
مواد قطبی در حلالهای قطبی بیشتر حل میشوند و مواد غیر قطبی در حلالهای غیر قطبی. برای رسوب دادن اغلب یونها، میتوان با افزودن یک حلال آلی امتزاج پذیر با آب، حلالیت آنها را کاهش داده، به صورت رسوب، آنها را جدا کرد.
• بجز این عوامل که توضیح داده شد عواملی مثل الکترولیتها، عوامل کمپلکس کننده، هیدرولیز، دما، فشار و اندازه ذرات در حلالیت رسوبها تأثیر دارند.
محاسبه وزن سنجی
محاسبه در وزن سنجی بر اساس استفاده از جرم اتمی یا ملکولی اجسام مورد نظر در واکنش شیمیایی صورت میگیرد. برای محاسبه وزن جز مورد نظر در یک رسوب، وزن رسوب را در ضریب وزن سنجی (F) ضرب میکنند:
در رابطه فوق W وزن رسوب و W۱، وزن جزء مورد نظر است F، ضریب وزن سنجی است.
درصد وزنی نیز با رابطه زیر محاسبه میشود:
مراحل وزن سنجی
۱. تشکیل رسوب
۲. صاف کردن
۳. شستشو
۴. خشک کردن در دمای مناسب
۵. سرد کردن تا دمای محیط
۶. توزین و محاسبه
منبع:
www. miadsoft. blogfa. com
شیمی تجزیه عمومی (برای دانشجویان مهندسی) گردآوری: دکتر ابولفضل سمنانی-دکتر علیرضا فیروز
لینک دانلود
رسوب گیری
وزن سنجی یک نمونه به روش رسوبگیری
این روش برای موادی که ترکیب شیمیایی آنها معین است، بکار میرود. در این روش، نمونه مورد نظر را از بقیه اجزا به صورت رسوبی که ترکیب شیمیایی آن معلوم است جدا کرده، پس از خشک و وزن کردن با ترازوی حساس، درصد وزنی آن را حساب میکنیم.
شرایط تهیه یک رسوب مناسب چیست؟
استوکیومتری
واکنشگر رسوب دهنده و جسم مورد نظر به نسبت وزنی معین و طبق فرمول شیمیایی با هم ترکیب میشوند، به عبارت دیگر واکنش آنها باید کمی باشد.
پایدار بودن
وزن رسوب در شرایط آزمایش باید ثابت بماند. مثلا نباید فرار یا قابل تجزیه بوده، قابلیت ترکیب با اجزای موجود در هوا و یا جذب آنها را داشته باشد.
خالص بودن و خوب صاف شدن
رسوبهای کلوئیدی که به سختی صاف میشوند، برای وزن سنجی مناسب نیستند.
انواع رسوبها از لحاظ فیزیکی
وضع فیزیکی رسوبها به اندازه، شکل و بار الکتریکی ذرات بستگی دارد.
رسوبهای بلوری
رسوبهای بلوری، درشت بوده، برای صاف کردن مناسب هستند. بنابراین بهترین رسوب برای وزن سنجی هستند. مانند
رسوبهای لختهای
رسوبهای لختهای مانند رسوب که شبیه شیر منعقد شده بوده، ذرات ریز بهم چسبیده و ذرات درشتتری ایجاد میکنند و در اثر شستشو با آب (عمل والختی)، دوباره به ذرات ریز تبدیل میشوند.
رسوبهای ژلاتینی
مانند فریک هیدروکسید هستند. قطر ذرات این رسوبها خیلی کوچک است، بنابراین از صافی رد میشوند و بعضی از آنها نیز سوراخهای صافی را مسدود کرده، باعث کندی عمل صاف کردن میشوند.
فرایند تشکیل رسوب
تشکیل رسوب، هم یک پدیده شیمیایی و هم یک پدیده فیزیکی است. پدیده شیمیایی تشکیل رسوب شامل واکنش شیمیایی واکنشگر و نمونه مورد نظر است. پدیده فیزیکی، شامل هستهزایی و رشد بلور (دو مرحله) است.
هستهزایی
تشکیل اولیه ذرات کوچک فاز جامد در فاز مایع را که از رسوب مورد نظر به حالت اشباع رسیده باشد، هستهزایی مینامند.
رشد بلور
رسوب کردن یونهای محلول روی ذرات اولیه را که سبب درشت شدن رسوبها میشود، رشد بلور مینامند.
ناخالصیهای موجود در رسوب
ناخالصیهای همرسوبی و انواع آن
همراهی مواد ناخالص محلول با رسوب تشکیل شده را همرسوبی مینامند و انواع آن عبارتند از:
• جذب سطحی:
در این حالت، ناخالصی فقط در سطح رسوب جذب میشود. مانند جذب سطحی یونهای نقره توسط رسوب کلرید نقره. رسوبهای کلوئیدی به دلیل جاذبه الکتریکی بارهای مخالف، بیشتر خاصیت جذب سطحی دارند.
• احتباس:
در این حالت، ناخالصیها در داخل رسوب هستند، یعنی فاز رسوب در حین تشکیل، مقداری از مواد ناخالص یا محلول اولیه را در بین ملکولهای خود به دام میاندازد. حتی با شستشو هم نمیتوان آنها را از هم جدا کرد.
• در برگیری:
در این روش، ناخالصیهایی که سیستم و ساختمان بلوری آنها با رسوب یکی است، همراه با ذرات رسوب، متبلور میشوند.
ناخالصیهای پس رسوب
در این حالت، پس از تشکیل رسوب، ترکیب دیگری که در شرایط آزمایش کم محلول است، رسوب کرده، لایهای از ناخالصیها روی رسوب اولیه را میپوشاند. به عنوان مثال در جدا کردن کلسیم از منیزیم توسط رسوب دادن با یون اکسالات، رسوب کلسیم اکسالات به آرامی تشکیل میشود. اگر محلول، مدتی بیش از اندازه لازم بماند، مقدار کمی منیزیم اکسالات روی کلسیم اکسالات رسوب میکند.
نکات مهم در رسوب گیری
• محلول جسم مجهول باید رقیق باشد و عامل رسوب دهنده قطره قطره به آن اضافه شود و همراه با همزدن محلول باشد. در این صورت تشکیل رسوب به آرامی صورت خواهد گرفت و احتباس کمترین مقدار را خواهد داشت.
• رسوب تشکیل شده را قبل از صاف کردن باید در حدود ده دقیقه روی حمام بخار آب، گرما داد. با این عمل ذرات ریزتر به علت حلالیت بیشتر دوباره حل شده، روی ذرات درشتتر رسوب میکنند. در نتیجه ذرات رسوب، درشتتر شده، سبب تقلیل جذب مواد خارجی بوسیله رسوب میشود.
حلالیت و حاصلضرب حلالیت یک رسوب
حلالیت رسوبها کم بوده، رفتار آنها در آب مانند الکترولیتها است، یعنی وقتی رسوب AB که دارای یک یون فلزی و یک آنیون یک ظرفیتی است، در آب تشکیل میشود. محلول از یونهای A و B اشباع میشود. مقدار رسوب حل شده را برحسب واحد مول در لیتر بیان میکنند و حاصلضرب غلظتهای A و B را حاصلضرب حلالیت رسوب () مینامند.
صحت روش وزن سنجی، به حلالیت رسوب تشکیل شده بستگی دارد.
عوامل موثر بر حلالیت
• اثر یون مشترک:
افزایش یک الکترولیت که دارای یک یون مشترک با رسوب است، سبب کم شدن حلالیت میشود.
• اثر PH محیط:
اگر به رسوبی که نمک یک اسید ضعیف است، یک اسید قویتر اضافه کنیم، مقداری از رسوب حل میشود. تشکیل هر رسوب باید در PH مناسب آن صورت گیرد. با کنترل PH یک محلول که شامل چند کاتیون است، میتوان آنها را به صورت رسوب هیدروکسید جدا کرد.
• اثر حلال:
مواد قطبی در حلالهای قطبی بیشتر حل میشوند و مواد غیر قطبی در حلالهای غیر قطبی. برای رسوب دادن اغلب یونها، میتوان با افزودن یک حلال آلی امتزاج پذیر با آب، حلالیت آنها را کاهش داده، به صورت رسوب، آنها را جدا کرد.
• بجز این عوامل که توضیح داده شد عواملی مثل الکترولیتها، عوامل کمپلکس کننده، هیدرولیز، دما، فشار و اندازه ذرات در حلالیت رسوبها تأثیر دارند.
محاسبه وزن سنجی
محاسبه در وزن سنجی بر اساس استفاده از جرم اتمی یا ملکولی اجسام مورد نظر در واکنش شیمیایی صورت میگیرد. برای محاسبه وزن جز مورد نظر در یک رسوب، وزن رسوب را در ضریب وزن سنجی (F) ضرب میکنند:
در رابطه فوق W وزن رسوب و W۱، وزن جزء مورد نظر است F، ضریب وزن سنجی است.
درصد وزنی نیز با رابطه زیر محاسبه میشود:
مراحل وزن سنجی
۱. تشکیل رسوب
۲. صاف کردن
۳. شستشو
۴. خشک کردن در دمای مناسب
۵. سرد کردن تا دمای محیط
۶. توزین و محاسبه
منبع:
www. miadsoft. blogfa. com
شیمی تجزیه عمومی (برای دانشجویان مهندسی) گردآوری: دکتر ابولفضل سمنانی-دکتر علیرضا فیروز
لینک دانلود
تئوری آزمایش سختی و سنگینی آب
تئوری آزمایش سختی و سنگینی آب
سختی و سنگینی آب
شاید تا به حال بارها و بارها در باره سختی آب و یا سنگینی آب شنیده باشید. اما هنوز تعریف دقیقی از این مفاهیم در ذهن نداشته باشید.
بسیاری از مردم این دو مفهوم را به یک معنا می دانند و تفاوتی بین این دو قائل نیستند. عده زیادی نیز واژه "سختی آب" را به جای "سنگینی آب" استفاده می کنند.
در اینجا به توضیح این مفاهیم و تفاوت های بین این دو مفهوم می پردازیم .
سنگینی آب (TDS)
TDS مخفف عبارت Total Dissolved Solid به معنای " کل جامدات محلول" است. منظور از TDS كل مواد جامد محلول در آب است كه برابر مجموع غلظت همه یونهای موجود در آب می باشد. مواد محلول در آب ممكن است از نظر ماهیت « آلی » یا « معدنی » باشند.
مواد غیر آلی ( معدنی ) حل شده در آب شامل : مواد معدنی ، فلزات و گازها می باشند. بعضی از مواد آلی به صورت ذرات كلوییدی هستند اما بیشتر مواد آلی به صورت محلول هستند. آلاینده های آلی ممكن است باعث بو ، رنگ و طعم نامطبوع آب شوند .
مواد حاصل از تجزیه گیاهان ، مواد شیمیایی آلی و گازهای آلی ، اجزای آلی محلول در آب را تشكیل می دهند .
بسیاری از مواد حل شده در آب نامطلوب هستند.مواد معدنی، گازها و مواد آلی حل شده در آب ممكن است موجب بروز رنگ ، طعم و بوی نامطلوب شوند. برخی از تركیبات شیمیایی ممكن است سمی باشند و برخی از اجزای آلی محلول به اثبات رسیده است كه سرطانزا هستند. البته باید توجه داشت كه تمامی مواد محلول در آب نامطلوب نیستند. اما میزان مواد محلول مطلوب در آب بسیار اندک است.
واحد سنجش TDS ، میلی گرم در لیتر Mg/l می باشد كه از آن با اصطلاح PPM یاد می كنند.
بنابراین جامدات و ناخالصی هایی که با عبور آب از سطوح و اعماق زمین در آب حل می شوند تشکیل TDS آب را می دهند. این همان مفهومی است که عموم مردم از آن به عنوان " سنگینی آب" یاد می کنند.
شاید بارها شنیده باشید که گفته می شود آب فلان منطقه "سنگین" است و آب منطقه ای دیگر " سبک " است. منظور از این عبارات همان تفاوت TDS آب مناطق مختلف است. باید توجه داشت که این مفهوم با مفهوم علمی "آب سنگین" که یک مفهوم در شیمی آب است متفاوت است. آب سنگین یکی از ایزوتوپ های مولکول آب است و با عبارت عامیانه " سنگینی آب" متفاوت است.
آنچه مسلم است هرچقدر ناخالصی های محلول ( خصوصا آن دسته از ناخالصی ها كه برای بدن مضر هستند نظیر نیترات ) در آب كمتر باشد آب گواراتر و سالم تر خواهد بود. از طرفی كاهش TDS ممكن است تغییر طعم آب را به دنبال داشته باشد و از آنجا كه طعم و مزه آب یك پارامتر نسبی است و برای مصرف كنندگان مختلف متفاوت است، آستانه تغییر مزه نیز قابل اندازه گیری نبوده و لذا در استاندارد ذكر نشده است.
می توان با کاهش TDS آب توسط دستگاههای تصفیه آب خانگی ، آبی به مراتب مطلوب تر و گواراتر تهیه و مصرف كرد. هر چه میزان TDS آب کمتر باشد، بر سلامت آب افزوده می شود. به وسیله تجهیزات تصفیه آب خانگی می توان میزان TDS آب را تا 90 در صد كاهش داد.
سختی کل (TH)
سختی کل جزئی از TDS است. منظور از سختی كل مجموع غلظت كلسیم و منیزیم موجود در آب است.بنا براین سختی آب ، بخشی از TDS آب است. عامل اصلی رسوب گذاری آب ، كاتیون های سختی با آنیونها در داخل آب واكنش داده و یك رسوب جامد ایجاد می نمایند. در آبهای طبیعی ، معمولا غلظت كلسیم حدود دو برابر منیزیم است در حالی كه در آب دریا غلظت منیزیم حدود 5 برابر كلسیم می باشد.
میزان سختی را برحسب mg/li CaCo3 بیان می كنند.
اثرات منفی آب سخت
از آنجا که سختی آب جزئی از سنگینی آب (TDS) است لذا با کاهش سنگینی آب و سبک کردن آب می توان سختی را نیز کاهش داد و از ایجاد رسوب جلوگیری کرد.
یکی از بهترین روشهای کاهش سنگینی و سختی آب روش اسمزمعکوس است. این فناوری در دستگاههای تصفیه آب خانگی استفاده می شود و آب را تا 90 درصد خالص تر می کند. امروزه استفاده از دستگاههای تصفیه آب خانگی جهت کاهش سنگینی و سختی آب و حذف ناخالصی های مضر حل شده در آب نظیر نیترات، تبدیل به یک ضرورت در کل دنیا شده است .
تئوری آزمایش سختی و سنگینی آب
سختی و سنگینی آب
شاید تا به حال بارها و بارها در باره سختی آب و یا سنگینی آب شنیده باشید. اما هنوز تعریف دقیقی از این مفاهیم در ذهن نداشته باشید.
بسیاری از مردم این دو مفهوم را به یک معنا می دانند و تفاوتی بین این دو قائل نیستند. عده زیادی نیز واژه "سختی آب" را به جای "سنگینی آب" استفاده می کنند.
در اینجا به توضیح این مفاهیم و تفاوت های بین این دو مفهوم می پردازیم .
سنگینی آب (TDS)
TDS مخفف عبارت Total Dissolved Solid به معنای " کل جامدات محلول" است. منظور از TDS كل مواد جامد محلول در آب است كه برابر مجموع غلظت همه یونهای موجود در آب می باشد. مواد محلول در آب ممكن است از نظر ماهیت « آلی » یا « معدنی » باشند.
مواد غیر آلی ( معدنی ) حل شده در آب شامل : مواد معدنی ، فلزات و گازها می باشند. بعضی از مواد آلی به صورت ذرات كلوییدی هستند اما بیشتر مواد آلی به صورت محلول هستند. آلاینده های آلی ممكن است باعث بو ، رنگ و طعم نامطبوع آب شوند .
مواد حاصل از تجزیه گیاهان ، مواد شیمیایی آلی و گازهای آلی ، اجزای آلی محلول در آب را تشكیل می دهند .
بسیاری از مواد حل شده در آب نامطلوب هستند.مواد معدنی، گازها و مواد آلی حل شده در آب ممكن است موجب بروز رنگ ، طعم و بوی نامطلوب شوند. برخی از تركیبات شیمیایی ممكن است سمی باشند و برخی از اجزای آلی محلول به اثبات رسیده است كه سرطانزا هستند. البته باید توجه داشت كه تمامی مواد محلول در آب نامطلوب نیستند. اما میزان مواد محلول مطلوب در آب بسیار اندک است.
واحد سنجش TDS ، میلی گرم در لیتر Mg/l می باشد كه از آن با اصطلاح PPM یاد می كنند.
بنابراین جامدات و ناخالصی هایی که با عبور آب از سطوح و اعماق زمین در آب حل می شوند تشکیل TDS آب را می دهند. این همان مفهومی است که عموم مردم از آن به عنوان " سنگینی آب" یاد می کنند.
شاید بارها شنیده باشید که گفته می شود آب فلان منطقه "سنگین" است و آب منطقه ای دیگر " سبک " است. منظور از این عبارات همان تفاوت TDS آب مناطق مختلف است. باید توجه داشت که این مفهوم با مفهوم علمی "آب سنگین" که یک مفهوم در شیمی آب است متفاوت است. آب سنگین یکی از ایزوتوپ های مولکول آب است و با عبارت عامیانه " سنگینی آب" متفاوت است.
آنچه مسلم است هرچقدر ناخالصی های محلول ( خصوصا آن دسته از ناخالصی ها كه برای بدن مضر هستند نظیر نیترات ) در آب كمتر باشد آب گواراتر و سالم تر خواهد بود. از طرفی كاهش TDS ممكن است تغییر طعم آب را به دنبال داشته باشد و از آنجا كه طعم و مزه آب یك پارامتر نسبی است و برای مصرف كنندگان مختلف متفاوت است، آستانه تغییر مزه نیز قابل اندازه گیری نبوده و لذا در استاندارد ذكر نشده است.
می توان با کاهش TDS آب توسط دستگاههای تصفیه آب خانگی ، آبی به مراتب مطلوب تر و گواراتر تهیه و مصرف كرد. هر چه میزان TDS آب کمتر باشد، بر سلامت آب افزوده می شود. به وسیله تجهیزات تصفیه آب خانگی می توان میزان TDS آب را تا 90 در صد كاهش داد.
سختی کل (TH)
سختی کل جزئی از TDS است. منظور از سختی كل مجموع غلظت كلسیم و منیزیم موجود در آب است.بنا براین سختی آب ، بخشی از TDS آب است. عامل اصلی رسوب گذاری آب ، كاتیون های سختی با آنیونها در داخل آب واكنش داده و یك رسوب جامد ایجاد می نمایند. در آبهای طبیعی ، معمولا غلظت كلسیم حدود دو برابر منیزیم است در حالی كه در آب دریا غلظت منیزیم حدود 5 برابر كلسیم می باشد.
میزان سختی را برحسب mg/li CaCo3 بیان می كنند.
اثرات منفی آب سخت
- باعث رنگین شدن ظروف سفالی و دیر پز شدن سبزیجات و بی رنگ شدن آنها می شود.
- باعث افزایش مصرف صابون و مواد شوینده می شود. ( یونهای كلسیم و منیزیم موجود در آب با صابون و مواد شوینده تركیب شده و آن را به صورت نامحلول در آورده و با رسوب دادن مواد صابونی ، عملا صابون را از نقش اصلی آن یعنی تمیز كردن باز می دارند. )
- باعث ایجاد لكه روی محصولات نساجی و مواد غذایی می شود.
- باعث تركیدگی دیگ های بخار ( به علت رسوب جداره داخلی دیگها ) می گردد.
- سبب رسوب املاح بر روی وسایل بهداشتی مانند دستشویی ، وان حمام و ... می شود.
از آنجا که سختی آب جزئی از سنگینی آب (TDS) است لذا با کاهش سنگینی آب و سبک کردن آب می توان سختی را نیز کاهش داد و از ایجاد رسوب جلوگیری کرد.
یکی از بهترین روشهای کاهش سنگینی و سختی آب روش اسمزمعکوس است. این فناوری در دستگاههای تصفیه آب خانگی استفاده می شود و آب را تا 90 درصد خالص تر می کند. امروزه استفاده از دستگاههای تصفیه آب خانگی جهت کاهش سنگینی و سختی آب و حذف ناخالصی های مضر حل شده در آب نظیر نیترات، تبدیل به یک ضرورت در کل دنیا شده است .
Similar threads
| Thread starter | عنوان | تالار | پاسخ ها | تاریخ |
|---|---|---|---|---|
| Y | ملزومات شیمی معدنی؛ برای دانشجویان داروسازی، علوم دارویی و شیمی دارویی | شیمی معدنی | 1 | |
| م | کتاب شیمی معدنی2 | شیمی معدنی | 3 | |
| ا | شیمی معدنی | شیمی معدنی | 0 | |
|
|
پستر های سمینار شیمی معدنی ایران | شیمی معدنی | 1 | |
| Z | دکترای شیمی معدنی | شیمی معدنی | 20 |
Similar threads
-
ملزومات شیمی معدنی؛ برای دانشجویان داروسازی، علوم دارویی و شیمی دارویی
- شروع شده توسط yalda125
- پاسخ ها: 1
-
-
-
-
