بله شما درست میگید .. من یکم بد توضیح دادم .. با تبخیر یک ماده ناخالص در حین فرایند تبخیر آرام آرام به دلیل افزایش ناخالصی دمای مایع افزایش پیدا می کنه که به اون می گن bpeمطمئن هستین؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟//
The general equation for calculations at dilute concentration[edit source | editbeta]
The extent of boiling-point elevation can be calculated by applying Clausius-Clapeyron relation and Raoult's law together with the assumption of the non-volatility of the solute. The result is that in dilute ideal solutions, the extent of boiling-point elevation is directly proportional to the molal Concentration of the solution according to the equation:[SUP][1][/SUP]
ΔT[SUB]b[/SUB] = K[SUB]b[/SUB] · b[SUB]B[/SUB]where
[*=left]ΔT[SUB]b[/SUB], the boiling point elevation, is defined as T[SUB]b (solution)[/SUB] - T[SUB]b (pure solvent)[/SUB].
[*=left]K[SUB]b[/SUB], the ebullioscopic constant, which is dependent on the properties of the solvent. It can be calculated as K[SUB]b[/SUB] = RT[SUB]b[/SUB][SUP]2[/SUP]M/ΔH[SUB]v[/SUB], where R is the gas constant, and T[SUB]b[/SUB] is the boiling temperature of the pure solvent [in K], M is the molar mass of the solvent, and ΔH[SUB]v[/SUB] is the heat of vaporization per mole of the solvent.
[*=left]b[SUB]B[/SUB] is the molality of the solution, calculated by taking dissociation into account since the boiling point elevation is a colligative property, dependent on the number of particles in solution. This is most easily done by using the van 't Hoff factor i as b[SUB]B[/SUB] = b[SUB]solute[/SUB] · i. The factor i accounts for the number of individual particles (typically ions) formed by a compound in solution. Examples:
- i = 1 for sugar in water
- i = 1.9 for sodium chloride in water, due to the near full dissociation of NaCl into Na[SUP]+[/SUP] and Cl[SUP]-[/SUP] (often simplified as 2)
- i = 2.3 for calcium chloride in water, due to nearly full dissociation of CaCl[SUB]2[/SUB] into Ca[SUP]2+[/SUP] and 2Cl[SUP]-[/SUP] (often simplified as 3)
Non integer i factors result from ion pairs in solution, which lower the effective number of particles in the solution.
Equation after including the van 't Hoff factor
ΔT[SUB]b[/SUB] = K[SUB]b[/SUB] · b[SUB]solute[/SUB] · iAt high concentrations, the above formula is less precise due to nonideality of the solution. If the solute is also volatile, one of the key assumptions used in deriving the formula is not true, since it derived for solutions of non-volatile solutes in a volatile solvent. In the case of volatile solutes it is more relevant to talk of a mixture of volatile compounds and the effect of the solute on the boiling point must be determined from the phase diagram of the mixture. In such cases, the mixture can sometimes have a boiling point that is lower than either of the pure components; a mixture with a minimum boiling point is a type of azeotrope.
===========================
http://en.wikipedia.org/wiki/Boiling-point_elevation
You are using an out of date browser. It may not display this or other websites correctly.
You should upgrade or use an alternative browser.
You should upgrade or use an alternative browser.
درخواست های مرتبط با | پرسش های درسی مهندسی شیمی
- شروع کننده موضوع حــامد
- تاریخ شروع
یعنی Boiling-point elevation اگه صفر باشه پس ماده خالص بوده یا مخلوط اثر آنچنانی بر روی نقطه جوش نداشته ( کشش سطحیزیاد تغییر نکرده)پس اون بخار در نقطه ی جوش رو میشه با فرض تقریبی بخار اشباع گرفت( سوپرهیتی است که مجبورا بخار اشباع در نظر میگیریم = نزدیک ترین حالت ممکن)
حالا BPE اگه صفر نبود پس حتما خواص کولیگاتیو رخ داده و دمای نقطه ی جوش مخلوط نسبت به حالت خالص رفته بالا پس در نتیجه فشار بخار اتفاق افتاده هم بیشتر از فشار بخار حالت خالص است
پس بخار سوپر هیت هست
مثلا آب در 100 درجه اولین بخاری که میاد بالا ( مجبورا بخار اشباع فرض می کنیم)
حالا آب نمک داریم : آب در 110 درجه اولین بخار میاد بالا --- دیگه این بخار سوپر هیت هست چون حالت بخار اشباع آّب خالص در 100 درجه است
؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟؟
من دقیقا سوالم همین هست که آیا فقط یک ماده خالصه که تشکیل بخار اشباع میده؟ که وقتی هم که دارای ناخالصی هست بخار حاصله از محلول ناخالصش بخار سوپر هیت هست؟
ممنونبله شما درست میگید .. ولی شما مشخص کنید که به جوش آوردن ماده خاص مد نظرتون هست یا ماده ناخالص !! با حرارت دادن ماده خالص وقتی به بقطه جوش می رسیم دیگه دما تغییرنمی کنه ولی برای ماده ی ناخالص وقتی تبخیر شروع میشه با پیشرفت تبخیر آرام آرام به دلیل افزایش ناخالصی در طول تبخیر دما افزایش پیدا می کنه که به این افزایش صعود در نقطه جوش میگن ...
مثلا همون ماده خالص رو اگه در نظر بگیریم سوال من این هستش که چرا بخاری که در لحظه اول تشکیل میشه رو بخار اشباع در نظر نمی گیریم اما اونی که در لحظه اخره بخار اشباع در نظر می گیریم در حالی که هر دوتاشون در یک دما هستند؟ دمای اشباع ما هم دمایی هست که بخار ما از همون ابتدا تا انتها داره؟درسته؟
یه جورایی درست میگید ...من دقیقا سوالم همین هست که آیا فقط یک ماده خالصه که تشکیل بخار اشباع میده؟ که وقتی هم که دارای ناخالصی هست بخار حاصله از محلول ناخالصش بخار سوپر هیت هست؟
بخار اشباع رو میشه هم از ماده خالص و هم از ماده ناخالص تهیه کرد !!ولی از ماده ناخالص خیلی سخت تر میشه اینکار رو کرد !! اگه به بخار اشباع حرارت بیشتری بددیم تبدیل به بخار سوپرهیت میشه ... پس یعنی برای مایعات ناخالص چون حرارت بیشتری می دیم بخار سوپر هیت داریم ...
برای درک بیشتر این دو شما فرض کنید که ترکیبی دارای بخار مشخصی ست .. دما را کاهش می دهیم در ان دمایی که میعان شروع می شود بخار اشباع داریم !! و اگر دما را بیشتر از آن قرار دهیم بخار سوپر هیت خواهیم داشت !!
ممنون
مثلا همون ماده خالص رو اگه در نظر بگیریم سوال من این هستش که چرا بخاری که در لحظه اول تشکیل میشه رو بخار اشباع در نظر نمی گیریم اما اونی که در لحظه اخره بخار اشباع در نظر می گیریم در حالی که هر دوتاشون در یک دما هستند؟ دمای اشباع ما هم دمایی هست که بخار ما از همون ابتدا تا انتها داره؟درسته؟
طبق تعریف، حداکثر مقدار بخار در هوا را بخار اشباع می گوییم پس قاعدتا قطره اول نمی تواند بخار اشباع رو نتیجه بدهد ... با پیش رفتن روند تبخیر آرام ارام میزان بخار افزایش یابد تا به حداکثر خود در دمای ثابت برسد که در آن لحضه بخر اشباع داریم از ان به بعد دیگر همان میزان که تبخیر می شود میعان نیز می یابد ...
ممنونیه جورایی درست میگید ...
بخار اشباع رو میشه هم از ماده خالص و هم از ماده ناخالص تهیه کرد !!ولی از ماده ناخالص خیلی سخت تر میشه اینکار رو کرد !! اگه به بخار اشباع حرارت بیشتری بددیم تبدیل به بخار سوپرهیت میشه ... پس یعنی برای مایعات ناخالص چون حرارت بیشتری می دیم بخار سوپر هیت داریم ...
برای درک بیشتر این دو شما فرض کنید که ترکیبی دارای بخار مشخصی ست .. دما را کاهش می دهیم در ان دمایی که میعان شروع می شود بخار اشباع داریم !! و اگر دما را بیشتر از آن قرار دهیم بخار سوپر هیت خواهیم داشت !!
اما چرا نمیشه در ماده ناخالص بخار اشباع داشت؟بالاخره وقتی به یک مخلوط هم حرارت میدیم ازش بخاری حاصل میشه (در همون دمای جوش خودش) که این بخار وقتی ازش حرارت میگیریم مثل حالتی که ماده خالص داریم تبدیل به مایع میشه!!!! اینطور نیست؟
یعنی تا زمانی که به صورت حباب هستند بخار اشباعند؟ پس چطور گفته میشه بخار اشباع بخاریه که در تعادل با آخرین قطره مایع باشه؟یا مثلا چطور گاهی اوقات گفته میشه که خوراک ورودی به برج تقطیر به صورت بخار اشباعه؟
نه تا زمانی که حباب هست که مایع هست
به محض ترکیدن حباب بخار اشباع(=مایع اشباع) است و یک نانو ثانیه بعد بخار سوپرهیت هست
پس چطور گفته میشه بخار اشباع بخاریه که در تعادل با آخرین قطره مایع باشه؟
این حالت فرض ریاضی هست و عملا در واقعیت اتفاق نمیفته
یعنی اینکه ما داریم به ظرف حرارت میدیم کم کم میرسه به نقطه ی جوش در نقطه ی جوش هر چی حرارت بدی باعث بالا رفتن دمای ماده نمیشه بلکه باعث تغییر فاز مولکول ها از حالت مایع به بخارمی شود ( یا همان گرمای نهان ذوب می شود -نیروی پیوندی هیدروژنی احتمالا می شود = که باید در ترمودینامیک پیشرفته یا ترمودینامیک آماری بررسی کرد= یعنی اگه زاویه ارتعاش بین مولکول آب در فاز مایع 104.5 است این یک کشش سطحی رو برای آّب در فاز مایع ایجاد میکنه که درحالت حبابی شکل شدن در حال تغییر است و در حالت بخار باند های پیوندی مولکول آب رزونانس کمتری پیدا میکنند و کشش سطحی دیگری دارند )
و این گرما در نقطه ی جوش اول مولکول آب را از حالت مایع به بخار در می آورد و به محض اینکه آخرین مولکول آب از حالت مایع به حالت بخار رسید ، گرمای داده شده صرف افزایش دمای بخار می شود
البته باز میشه گفت دما رو شما چی فرض کنی ( معیاری برای سنجش گرمای جسم؟؟؟ گرما انرژی است. انرژِ ی چیست؟؟؟؟ هنوز تعریف دقیقی از انرژی در جهان مطرح نشده)
ولی تو درس شیمی فیزیک خوندین که گرما رو میانگینی از سرعت متوسط مولکول ها در نظر گرفت (منظورم ساده نرین حالت بود که رفتار مولکول هل ها را با تئوری جنبش گاز ها مدل میکرد که یک فرمولی هم داشت، نمیدونم یک سوم جرم مولکولی ضربدر فلان و ......)
برای همین هست این ثابت هایی که فرض میشه : مثل k بر حسب ثابت گازها (R) بیان می شوند
In thermodynamics, the ebullioscopic constant, K[SUB]b[/SUB], allows one to relate molality to boiling point elevation. It is the ratio of the latter to the former:

i is the Vant Hoff factor. It is determined by whether the solute particles in the solution associate or dissociate. If all the particles of the solute trimerise (Three associate into one) the Vant hoff factor will be 1/3. If they dissociate into two particles (For example NaCl as solute which breaks into Na[SUP]+[/SUP] and Cl[SUP]-[/SUP]), i=2.

R - Ideal Gas constant
T[SUB]b[/SUB] - Boiling point of liquid.
L[SUB]v[/SUB] - Latent heat of vaporisation per gram.
Through the procedure called ebullioscopy, a known constant can be used to calculate an unknown molar mass. The term "ebullioscopy" comes from the Greek language and means "boiling measurement." This is related to cryoscopy, which determines the same value from the cryoscopic constant (of freezing point depression).
This property of elevation of boiling point is a colligative property. It means that the property, in this case
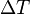 depends on the number of particles dissolved into the solvent and not the nature of those particles.
depends on the number of particles dissolved into the solvent and not the nature of those particles.

i is the Vant Hoff factor. It is determined by whether the solute particles in the solution associate or dissociate. If all the particles of the solute trimerise (Three associate into one) the Vant hoff factor will be 1/3. If they dissociate into two particles (For example NaCl as solute which breaks into Na[SUP]+[/SUP] and Cl[SUP]-[/SUP]), i=2.

R - Ideal Gas constant
T[SUB]b[/SUB] - Boiling point of liquid.
L[SUB]v[/SUB] - Latent heat of vaporisation per gram.
Through the procedure called ebullioscopy, a known constant can be used to calculate an unknown molar mass. The term "ebullioscopy" comes from the Greek language and means "boiling measurement." This is related to cryoscopy, which determines the same value from the cryoscopic constant (of freezing point depression).
This property of elevation of boiling point is a colligative property. It means that the property, in this case
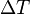
=============================================================
http://en.wikipedia.org/wiki/Ebullioscopic_constant
یعنی خوراک اگه خالص بوده دمای جوشش رو با آزمایش یا از تو هندبوک به دست میارن و قبل از ورود به برج با هیتر به اون دما میرسونن تا مطمئن باشن که با حالت بخاروارد شده
یعنی با توجه به دبی ورودی و مقدار جرم رودی ، گرمای لازم برای بخار شدن و همچنین + گرمای نهان تبخیرشو حساب میکنن بعد هیتر رو رو اون دما و گرما و میزان مصرف سوخت تنظیم میکنن
مایع اشباع = در دمای a ، اولین مولکول می خواهد بخار شود = دمای حباب
بخار اشباع = در همان دمای a ، آخرین مولکول در فاز مایع دارد تبدیل به فاز بخار میشود = حالت عکسش میشه تعریف دمای شبنم
بخار اشباع در یک نانو ثانیه اتفاق می افتدواز اونبه بعد بخار سوپر هیت داریم
بین این ها = همان دمای a ،یعنی از لحاظ دمایی تغییری نداریم در حالت خالص
بهتر بگم:
دمای مایع اشباع = دمای بخاراشباع
حالا اگه ناخالص باشه:
دمای بخار اشباع با دمای مایع اشباع فرق میکنه( درست میگم؟؟؟؟؟؟)
در حالت ناخالص دیگه ما نقطه ی جوش نداریم و رنج جوش داریم ( درسته؟؟؟)
بخار اشباع = در همان دمای a ، آخرین مولکول در فاز مایع دارد تبدیل به فاز بخار میشود = حالت عکسش میشه تعریف دمای شبنم
بخار اشباع در یک نانو ثانیه اتفاق می افتدواز اونبه بعد بخار سوپر هیت داریم
بین این ها = همان دمای a ،یعنی از لحاظ دمایی تغییری نداریم در حالت خالص
بهتر بگم:
دمای مایع اشباع = دمای بخاراشباع
حالا اگه ناخالص باشه:
دمای بخار اشباع با دمای مایع اشباع فرق میکنه( درست میگم؟؟؟؟؟؟)
در حالت ناخالص دیگه ما نقطه ی جوش نداریم و رنج جوش داریم ( درسته؟؟؟)
طبق تعریف، حداکثر مقدار بخار در هوا را بخار اشباع می گوییم پس قاعدتا قطره اول نمی تواند بخار اشباع رو نتیجه بدهد ... با پیش رفتن روند تبخیر آرام ارام میزان بخار افزایش یابد تا به حداکثر خود در دمای ثابت برسد که در آن لحضه بخر اشباع داریم از ان به بعد دیگر همان میزان که تبخیر می شود میعان نیز می یابد ...
ممنونم
کاملا متوجه شدم
 پس با این حساب بخاری که در لحظات ابتدایی داریم مثلا برای ماده خالص آب همون بخار آب هستش ودر نهایت بخاری که در آخرین لحظات داریم بخار اشباع هستش درسته؟
پس با این حساب بخاری که در لحظات ابتدایی داریم مثلا برای ماده خالص آب همون بخار آب هستش ودر نهایت بخاری که در آخرین لحظات داریم بخار اشباع هستش درسته؟و دمای اشباع و فشار اشباع هم که چه در لحظات اولیه و چه در لحظات پایانی یکی هستش درسته؟
ممنون
اما چرا نمیشه در ماده ناخالص بخار اشباع داشت؟بالاخره وقتی به یک مخلوط هم حرارت میدیم ازش بخاری حاصل میشه (در همون دمای جوش خودش) که این بخار وقتی ازش حرارت میگیریم مثل حالتی که ماده خالص داریم تبدیل به مایع میشه!!!! اینطور نیست؟
بخار فیزیکی داریم
اما تعریف ریاضی بخار اشباع نداریم
چون نیرو های پیوندی بین مولکول های مختلف فرق میکنه و به ترتیب بخار نمیشن و دلخواه و به صورت تصادفی ( ترمودینامیک آماری)
بله ...ممنونم
کاملا متوجه شدمپس با این حساب بخاری که در لحظات ابتدایی داریم مثلا برای ماده خالص آب همون بخار آب هستش ودر نهایت بخاری که در آخرین لحظات داریم بخار اشباع هستش درسته؟
و دمای اشباع و فشار اشباع هم که چه در لحظات اولیه و چه در لحظات پایانی یکی هستش درسته؟
سوال دومتون رو متوجه نشدم ... ولی درمورد دما و فشار می تونم بهتون بگم که با داشتن ترکیب درصد مواد درجه ازادی سیستم یک میشه و با داشتن دما می تونیم فشار بخار اشباع رو محاسبه کنیم و بلعکس !!
و اینکه میگید لحظه اول و اخر رو متوجه نشدم !! اخه ما یا بخار اشباع داریم ویا نداریم !!
ممنونممایع اشباع = در دمای a ، اولین مولکول می خواهد بخار شود = دمای حباب
بخار اشباع = در همان دمای a ، آخرین مولکول در فاز مایع دارد تبدیل به فاز بخار میشود = حالت عکسش میشه تعریف دمای شبنم
بخار اشباع در یک نانو ثانیه اتفاق می افتدواز اونبه بعد بخار سوپر هیت داریم
بین این ها = همان دمای a ،یعنی از لحاظ دمایی تغییری نداریم در حالت خالص
بهتر بگم:
دمای مایع اشباع = دمای بخاراشباع
حالا اگه ناخالص باشه:
دمای بخار اشباع با دمای مایع اشباع فرق میکنه( درست میگم؟؟؟؟؟؟)
در حالت ناخالص دیگه ما نقطه ی جوش نداریم و رنج جوش داریم ( درسته؟؟؟)
بله کاملا درسته
با توجه به توضیحات شما برای یک ماده خالص تمودار تعادلی t-xy نمودار شبنم و نمودار حباب روی هم منطبق میشن؟
مایع اشباع = در دمای a ، اولین مولکول می خواهد بخار شود = دمای حباب
بخار اشباع = در همان دمای a ، آخرین مولکول در فاز مایع دارد تبدیل به فاز بخار میشود = حالت عکسش میشه تعریف دمای شبنم
بخار اشباع در یک نانو ثانیه اتفاق می افتدواز اونبه بعد بخار سوپر هیت داریم
بین این ها = همان دمای a ،یعنی از لحاظ دمایی تغییری نداریم در حالت خالص
بهتر بگم:
دمای مایع اشباع = دمای بخاراشباع
حالا اگه ناخالص باشه:
دمای بخار اشباع با دمای مایع اشباع فرق میکنه( درست میگم؟؟؟؟؟؟)
در حالت ناخالص دیگه ما نقطه ی جوش نداریم و رنج جوش داریم ( درسته؟؟؟)
بله .. کاملا درسته !!
ممنونم
بله کاملا درسته
با توجه به توضیحات شما برای یک ماده خالص تمودار تعادلی t-xy نمودار شبنم و نمودار حباب روی هم منطبق میشن؟
بله .. این هم درسته !!
ممنونم
بله کاملا درسته
با توجه به توضیحات شما برای یک ماده خالص تمودار تعادلی t-xy نمودار شبنم و نمودار حباب روی هم منطبق میشن؟
بله منطبق میشن
منظورم از لحظه ابتدایی لحظه اولیه که ماده خالص ما شروع به جوشیدن می کنه و لحظه پایانی لحظه ای هستش که بخار اشباع داریم منظورم این هستش چون از لحظه اتدایی که مایع به جوش میاد تا زمانی که تبدیل به بخار اشباع میشه دما و فشار که تغییر نمیکنه پس دمای اشباع و فشار اشباع ما در هر دو لحظه یکی هستشبله ...
سوال دومتون رو متوجه نشدم ... ولی درمورد دما و فشار می تونم بهتون بگم که با داشتن ترکیب درصد مواد درجه ازادی سیستم یک میشه و با داشتن دما می تونیم فشار بخار اشباع رو محاسبه کنیم و بلعکس !!
و اینکه میگید لحظه اول و اخر رو متوجه نشدم !! اخه ما یا بخار اشباع داریم ویا نداریم !!
ممنونم از همه راهنمایی هاتونبله ...
سوال دومتون رو متوجه نشدم ... ولی درمورد دما و فشار می تونم بهتون بگم که با داشتن ترکیب درصد مواد درجه ازادی سیستم یک میشه و با داشتن دما می تونیم فشار بخار اشباع رو محاسبه کنیم و بلعکس !!
و اینکه میگید لحظه اول و اخر رو متوجه نشدم !! اخه ما یا بخار اشباع داریم ویا نداریم !!

ممنون از همه راهنمایی هاتونبله منطبق میشن
مراحل تولید محصولات شیمیایی
مراحل تولید محصولات شیمیایی
با سلام.
میخواستم توالی های مثل زیر رو اگه ازش اطلاع دارید بنویسید:
http://www.mediafire.com/view/0bz5x9cemz4hjde/123.jpg
قبلا یک تاپیک جدا زده بودم ولی حذف شد.نمیدونم چرا!
مراحل تولید محصولات شیمیایی
با سلام.
میخواستم توالی های مثل زیر رو اگه ازش اطلاع دارید بنویسید:
http://www.mediafire.com/view/0bz5x9cemz4hjde/123.jpg
قبلا یک تاپیک جدا زده بودم ولی حذف شد.نمیدونم چرا!
سلام
مقاله ای در مورد تولید اتیلن اکساید می خواستم
با تشکر
پروژه ای لاتین در مورد اکسید اتیلن:
-------------------------------------------------------------------------------------------------
A. Material Balances
http://www.mediafire.com/?0fr853pinet5ltz
B. Material Balances, Energy Balances, Numerical Methods, and Optimization
http://www.mediafire.com/?i5293wsn6li13pt
C-Fluids, Heat, Thermodynamics plus topics in A and B
http://www.mediafire.com/?p8kcl1ttkaw81g9
D. Separations and Reactors plus topics in C -- these may also be suitable for capstone design
http://www.mediafire.com/?thl9ic5ba7oa5pz
ahmad yousefi
عضو جدید
سيكلون
سيكلون
سلام دوستان
كسي مطلب يا نرم افزاري در مورد طراحي سيكلون ميشناسه؟
سيكلون
سلام دوستان
كسي مطلب يا نرم افزاري در مورد طراحي سيكلون ميشناسه؟
reza.mahdavi
عضو جدید
درخواست آزمون های آزمایشی ارشد
درخواست آزمون های آزمایشی ارشد
سلام ، اگه کسی آزمون های آزمایشی ارشد موسساتی مثل سنجش ، پارسه و ... همراه با جواب تشریحی رو داره بی زحمت آپلود کنه
درخواست آزمون های آزمایشی ارشد
سلام ، اگه کسی آزمون های آزمایشی ارشد موسساتی مثل سنجش ، پارسه و ... همراه با جواب تشریحی رو داره بی زحمت آپلود کنه
سلام ، اگه کسی آزمون های آزمایشی ارشد موسساتی مثل سنجش ، پارسه و ... همراه با جواب تشریحی رو داره بی زحمت آپلود کنه
سلام. تو تالار كارشناسي ارشد و دكترا بگردين پيدا ميكنين
reza.mahdavi
عضو جدید
درخواست آزمون های آزمایشی ارشد
درخواست آزمون های آزمایشی ارشد
سلام تو اون تالار آزمون های جامع پارسه بدون جوابه
اگه آزمون آزمایشی سنجشو دارید بزارید
درخواست آزمون های آزمایشی ارشد
سلام تو اون تالار آزمون های جامع پارسه بدون جوابه
اگه آزمون آزمایشی سنجشو دارید بزارید
کسری گودرزی
عضو جدید
کمک...کتابی یهم معرفی کنید که من که تازه اومدم مهندسی شیمی چیزی ازش بفهمم
کمک...کتابی یهم معرفی کنید که من که تازه اومدم مهندسی شیمی چیزی ازش بفهمم
سلام من کاردانی جوش خوندم ولی به دلایلی اومدم مهندسی صنایع شمیایی ادامه بدم کتابی بهم معرفی کنید که بتونم جیزی از شیمی بفهمم.لینک دانلودشو بزارین که اثلا گلید گل
کمک...کتابی یهم معرفی کنید که من که تازه اومدم مهندسی شیمی چیزی ازش بفهمم
سلام من کاردانی جوش خوندم ولی به دلایلی اومدم مهندسی صنایع شمیایی ادامه بدم کتابی بهم معرفی کنید که بتونم جیزی از شیمی بفهمم.لینک دانلودشو بزارین که اثلا گلید گل

مهندس علی
کاربر فعال
نظر برو مکانیک
اصلا شیمی بازار کار نداره
اما خواستی کتاب بخونی برو تو ملاصدرا کتابفروشی محمدی بگو کتاب آشنایی با مهندسی شیمی می خوام یا اگر می خوای با یه تیر 10 نشون بزنی
کتاب عملیات واحد مک کیب یا
کتاب اصول جداسازی الی ای سیدر و یا
فصل اول کتاب انتقال جرم تریبال کمک می کنند تا گستره مهندسی شیمی را درک کنی
کتاب موازنه انرژی و مواد هیمل بلاو را اگر دوست داری برو فقط مثال ها یا سوالات آخر فصل اش را بخون ببینی گستره آن کجا است
همه این کتاب ها جزو سیلابس درس ات هستند و اگر هم بخری ضرر نمی کنی
اگر هم دوست نداری توی باشگاه بگردی می تونی کتاب های اصلی را بیابی
اصلا شیمی بازار کار نداره
اما خواستی کتاب بخونی برو تو ملاصدرا کتابفروشی محمدی بگو کتاب آشنایی با مهندسی شیمی می خوام یا اگر می خوای با یه تیر 10 نشون بزنی
کتاب عملیات واحد مک کیب یا
کتاب اصول جداسازی الی ای سیدر و یا
فصل اول کتاب انتقال جرم تریبال کمک می کنند تا گستره مهندسی شیمی را درک کنی
کتاب موازنه انرژی و مواد هیمل بلاو را اگر دوست داری برو فقط مثال ها یا سوالات آخر فصل اش را بخون ببینی گستره آن کجا است
همه این کتاب ها جزو سیلابس درس ات هستند و اگر هم بخری ضرر نمی کنی
اگر هم دوست نداری توی باشگاه بگردی می تونی کتاب های اصلی را بیابی
باباعلي النود
عضو جدید
درخواست راهنمايي
درخواست راهنمايي
با سلام پروژه اي را شروع كردم كه در مورد كاربردهاي گاز اتيلن اكسايد هم در اون بايد مطلب بنويسم از بزرگواران هم باشگاهي اگر كسي مطالبي در خصوص كاربردهاي اين گاز استراتژيك داره برام ميل كنه لطفا ar.rahimi.49@gmail.com
درخواست راهنمايي
با سلام پروژه اي را شروع كردم كه در مورد كاربردهاي گاز اتيلن اكسايد هم در اون بايد مطلب بنويسم از بزرگواران هم باشگاهي اگر كسي مطالبي در خصوص كاربردهاي اين گاز استراتژيك داره برام ميل كنه لطفا ar.rahimi.49@gmail.com
سید مهدی برقعی
عضو جدید
بزرگواران ممکنه لطفی کنید و این مقاله رو برام تهیه کنید ؟
[h=1]CONTRIBUTIONS TO THE KNOWLEDGE OF HALOGENATION. VII.[SUP]1[/SUP] SUBSTITUTED NITROGEN CHLORIDES. THE ACTION OF CHLORINE ON CARBAMIC ESTERS AND BIURETS AND THE PREPARATION OF CHLOROCARBAMIC ESTERS AND CHLOROBIURETS.[/h]
Rasik Lal Datta , Satyaranjan Das Gupta
J. Am. Chem. Soc., 1915, 37 (3), pp 569–578
DOI: 10.1021/ja02168a016
Publication Date: March 1915
[h=1]CONTRIBUTIONS TO THE KNOWLEDGE OF HALOGENATION. VII.[SUP]1[/SUP] SUBSTITUTED NITROGEN CHLORIDES. THE ACTION OF CHLORINE ON CARBAMIC ESTERS AND BIURETS AND THE PREPARATION OF CHLOROCARBAMIC ESTERS AND CHLOROBIURETS.[/h]
Rasik Lal Datta , Satyaranjan Das Gupta
J. Am. Chem. Soc., 1915, 37 (3), pp 569–578
DOI: 10.1021/ja02168a016
Publication Date: March 1915
amirmohsensaberi
عضو جدید
مشاغل مهندسی شغلی
مشاغل مهندسی شغلی
سلام دوستان
کلن میخواستم راجعبه بازار کار مهندسی شیمی بدونم الان ترم 3 م.شیمی هستم و فقط میدونم تو پالایشگاه و اینا کار میکنیم ولی دقیقا نمیدونم کجاش و چی کار میکنیم اگه کسی اطلاعات داره ممنون میشم در اختیار منم بذارید
مشاغل مهندسی شغلی
سلام دوستان
کلن میخواستم راجعبه بازار کار مهندسی شیمی بدونم الان ترم 3 م.شیمی هستم و فقط میدونم تو پالایشگاه و اینا کار میکنیم ولی دقیقا نمیدونم کجاش و چی کار میکنیم اگه کسی اطلاعات داره ممنون میشم در اختیار منم بذارید
Similar threads
Similar threads
-
درخواست های مرتبط با | پرسش های فرایندی و واحدهای پتروشیمی و پالایشگاهی
- شروع شده توسط فاطمه یاس
- پاسخ ها: 278
-
درخواست های مرتبط با | جزوات درسی و گزارشکارهای ازمایشگاه
- شروع شده توسط nisa
- پاسخ ها: 689
-
درخواست های مرتبط با | حلّ تکالیف و مسائل درسی مهندسی شیمی
- شروع شده توسط پیرجو
- پاسخ ها: 323
-
اساسی ترین و مهمترین دوره های آموزشی مهندسی شیمی
- شروع شده توسط serato2011
- پاسخ ها: 6
-
درخواست های مرتبط با | مجله های مهندسی شیمی
- شروع شده توسط tarane62
- پاسخ ها: 65
