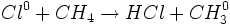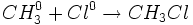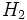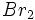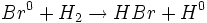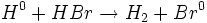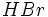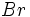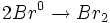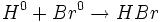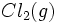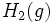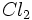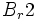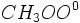واکنش تجزیه ، واکنشی است که در طی آن یک ماده مرکب به مواد سادهتری تبدیل میشود.
یک واکنش شیمیایی شامل تجزیه ، ترکیب یا بازآرایی اتمهاست.
برای انجام یک واکنش شیمیایی، ابتدا پیوندهای شیمیایی بین اتمها در مواد اولیه شکسته
میشود. سپس پیوندهای دیگری برای به وجود آوردن فراورده های جدید تشکیل میشوند. به
عبارتی، در یک واکنش، آرایش الکترونی اتمها در مولکولها تغییر مییابد و مواد جدیدی با خواص
متفاوت از مواد اولیه تولید میشود.
البته باید توجه داشت که در جریان یک واکنش شیمیایی ، اتمها نه بوجود میآیند و نه از بین
میروند، فقط ساختار اتمهای تشکیل دهنده مولکولها تغییر مییابد. صدها نوع واکنش شیمیایی
وجود دارد ولی میتوان آنها را در پنج نوع کلی زیر طبقهبندی نمود:
· واکنش سوختن
· واکنش تجزیه
· واکنش ترکیبی
· واکنش جابجایی یگانه
· واکنش جابجایی دوگانه
واکنش ترکیبی
واکنشی است که در آن ، چند ماده با هم ترکیب میشوند و یک یا چند فراورده تازهای با ساختاری
پیچیدهتر تولید میکنند. برای نمونه ، واکنش اتم هیدروژن و اکسیژن منجر به تشکیل مولکول آب
میشود یا در واکنشهای پلیمریزاسیون که در آنها از تجمع مولکولهای منفرد ، درشت مولکولهایی به
نام پلیمر تشکیل میشود.
واکنش سوختن
واکنشی است که در طی آن یک ماده ، به سرعت با اکسیژن ترکیب و طی آن ، مقدار زیادی انرژی
بصورت نور و گرما آزاد میشود. امروزه هنوز هم واکنش سوختن برای تولید انرژی استفاده میشود،
زیرا سوختهای فسیلی ، اصلیترین و ارزانترین منبع تولید انرژی هستند. سوختن هیدروکربنها و
واکنش فلزات قلیایی و قیایی خاکی (بجز Be) و بعضی ترکیبهای دیگر یا اکسیژن از نوع سوختن
هستند و با آزاد کردن گرما و نور شدید همراهند.
گرما + اکسید فلز <----- (حرارت) اکسیژن + فلز
واکنش جابجایی یگانه
در واکنش جانشینی یگانه ، یک عنصر یا یون ، جایگزین عنصر یا یون دیگری در یک ترکیب میشود.
برای مثال ، واکنش فلزهای قلیایی و قلیایی خاکی با آب که به تولید گاز هیدروژن میانجامد، از
جمله واکنشهای جابجایی یگانه بشمار میآیند.
(2K(s) + 2H[SUB]2[/SUB]O(l)→H[SUB]2[/SUB](g) + 2KOH (aq
واکنش جانشینی دوگانه
در این نوع واکنش ، جای دو عنصر در ترکیب با هم عوض میشود. واکنشهای رسوبی که در آنها
مخلوط کردن محلول دو نمک به تشکیل یک نمک نامحلول میانجامد، از مهمترین واکنشها در این
دسته است. واکنش اسیدها با بازها هم از این دسته واکنشهاست.
NaOH + HCl→H[SUB]2[/SUB]O + NaCl
Pb(NO[SUB]3[/SUB])[SUB]2[/SUB](aq) + 2KI(aq)→ PbI[SUB]2[/SUB](s) + 2KNO[SUB]3[/SUB]
واکنش تجزیه
واکنشی است که در آن ، یک ماده به دو یا چند ماده سادهتر تبدیل میشود. در واقع در واکنش تجزیه ،
پیوند شیمیایی بین اتم ها در یک ماده شکسته میشود و برای این منظور ، باید انرژی مصرف شود.
همواره برای آغاز یک واکنش به مقداری انرژی نیاز است. به حداقل انرژی لازم برای شروع یک واکنش
شیمیایی انرژی فعالسازی می گویند. دادن گرما ، تابش نور ، ایجاد جرقه ، تخلیه الکتریکی یا وارد
کردن یک شوک مانند ضربه یا افزایش ناگهانی فشار ، این انرژی فعالسازی را تامین میکند.
بعد از شکسته شدن پیوندها در ماده اولیه ، پیوندهای جدیدی تشکیل میشود که منجر به تولید دو
یا چند ماده جدید میشود. واکنش تجزیه ممکن است بر روی یک ماده ساده که فقط از دو نوع اتم
تشکیل شده باشد صورت گیرد که در این صورت ، یک مولکول به اتمهای سازندهاش تفکیک میشود.
ترکیب میتواند تجزیه شود
نمونههایی از واکنش تجزیه:
تجزیه مولکول آب نمونهای از این واکنشهاست.
(H[SUB]2[/SUB]O→H[SUB]2[/SUB](g) + 1/2 O[SUB]2[/SUB](g
و همچنین اگر مادهای با انواع اتمها داشته باشیم، در اینصورت ، در اثر واکنش تجزیه ، یک مولکول
به دو یا چند مولکول ساده دیگر تبدیل میشود. برای نمونه ، کربناتها و بیکربناتها بر اثر گرما تجزیه
میشوند و گاز کربن دیاکسید آزاد میکنند.
2NaHCO[SUB]3[/SUB](s) →Na[SUB]2[/SUB]CO[SUB]3[/SUB](s) + H[SUB]2[/SUB]O(g)+CO[SUB]2
[/SUB]
CaCO[SUB]3[/SUB](s)→CaO(s) + CO[SUB]2[/SUB]
ترکیبهایی مانند نیتراتها و کلراتها بر اثر گرما ، اکسیژن آزاد میکنند.
2KClO[SUB]3[/SUB](s)→2KCl(s) + 3O[SUB]2[/SUB]
2KNO[SUB]3[/SUB](s)→2KNO[SUB]2[/SUB] + O[SUB]2[/SUB]
واکنش از دست دادن آب تبلور نمکها هم از این دسته واکنشهاست.