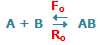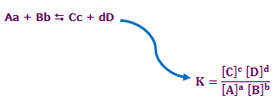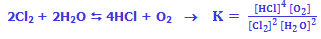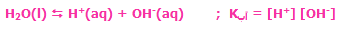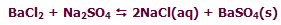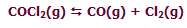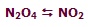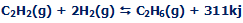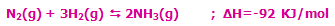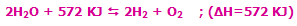You are using an out of date browser. It may not display this or other websites correctly.
You should upgrade or use an
alternative browser.
تعادل شیمیایی و مباحث مرتبط
کاربر فعال تالار شیمی
کاربر ممتاز
· تعادل چیست؟
· چگونه به سرعت میتوان به تعادل در یک واکنش شیمیایی رسید؟
· آیا دما روی تعادل و آهنگ واکنش تأثیر دارد؟
· ثابت تعادل چیست؟
· آیا تعادل روی مقدار محصولات واکنش (بازده) تأثیر دارد؟
در این مجموعه به تمامی سؤالات بالا پاسخ خواهیم داد.
اما به راستی تعادل چیست؟ تعادل شیمیایی و تعادل فیزیکی چگونه حاصل میشوند؟
زمانیکه یک واکنش شیمیایی شروع میشود، ابتدا واکنش دهندهها وارد عمل میشوند.
رفته رفته از غلظت واکنش دهندهها کم شده و به غلظت محصولات اضافه میشود. در
نهایت، زمانی میرسد که هیچ تغییری در غلظت واکنش دهندهها و محصولات مشاهده
نمیشود. چنین واکنشهایی که در آنها فقط قسمتی از مقدار کلی واکنش دهندهها
به محصول تبدیل میشود، فرایندهای برگشتپذیر نامیده میشوند.
تعادل زمانی است که:
-هر تغییری در طول واکنش برگشتپذیر است و میتواند با معادلهای که شامل یک فلش
دوطرفه است، نشان داده شود.
-سیستم تعادلی، محصور و بسته است؛ سیستم بسته و محصور به سیستمی گفته می
شود که هیچ مادهای نتواند وارد یا خارج این سیستم شود.
-در حالت تعادل، سیستم پویا است؛ گویی در مقیاس ماکروسکوپی به نظر میرسد هیچ
اتفاقی نیفتاده است اما در مقیاس ریز، تغییرات برگشتپذیر به طور متوالی روی میدهند.
تعادل فیزیکی شامل تغییرات خواص شیمیایی مواد مرتبط با واکنش نیست. برای نمونه،
تعادل بخار آب با خود آب در یک بطری در بستهی نیمه پر یک تعادل فیزیکی است زیرا مولکول
های آب فقط از مایع به بخار تبدیل میشوند.
تعادل شیمیایی با تغییر در ترکیب شیمیایی مواد، شکستن و تشکیل پیوند مرتبط است.
یک مثال برای این تغییر، تجزیهی اسید استیک است. مبادلهی ذرات بین یونها و مولکولها
در این تجزیه وجود دارد؛ زمانی که تعادل حاصل میشود، آهنگ مبادلهی ذرات بین یونها و
مولکولها مساوی میشود.
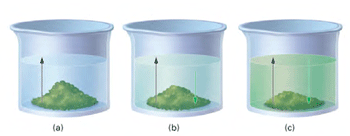
مثال 1 از تعادل فیزیکی:
تا مرحلهی 3، آهنگ تبخیر و آهنگ میعان کاملاً با هم متفاوتند و عمل تبخیر، بیشتر صورت
میگیرد اما با گذشت زمان، میعان هم رو به افزایش است. در مرحلهی 3 و 4 آهنگ تبخیر
و آهنگ میعان برای هر تغییر فیزیکی برابرند.
در حالت (c) آهنگ رفت (حل شدن مادهی جامد در حلال) و آهنگ برگشت (بلوری شدن
مادهی حل شونده) در تعادل فیزیکیاند.
سؤال: در یک سیستم تعادلی، چه چیزهایی مساوی یا متعادل هستند؟
لزومی ندارد غلظت مواد در تعادل، کاملاً مساوی باشد.
فرایند هابر را به خاطر بسپارید (ساخت مواد خام و اولیه برای کود شیمیایی) :
در فشار و دمای اتاق، این واکنش تقریباً با هیچ NH[SUB]3[/SUB] در تعادل نیست.
آهنگ تغییر در مسیر رفت واکنش (از چپ به راست معادله) با آهنگ برگشت (از راست
به چپ) با هم مساویاند.
آهنگ واکنش
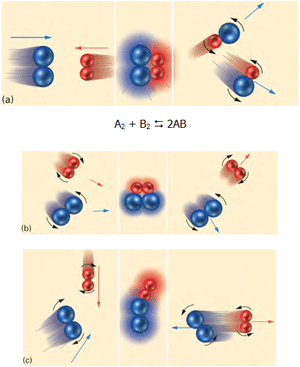
با استفاده از نظریهی برخورد در واکنشهای شیمیایی میتوان این مطلب را درک کرد.
یک تغییر شیمیایی که به طور ماکروسکوپی قابل مشاهده است، نتیجهی تعداد زیادی
از برخوردها مابین ذرات واکنش دهنده است.
در شکل زیر و در حالت a، مولکولهای آبی و قرمز به دلیل اینکه انرژی جنبشی کافی
و جهت مناسب دارند، واکنش انجام میگیرد.
در حالت b با اینکه مولکولها جهت مناسب دارند ولی انرژی جنبشی کافی ندارند،
واکنش انجام نمیگیرد. در حالت c مولکولها در برخورد با هم انرژی جنبشی کافی
دارند اما جهتگیری آنها مناسب نیست؛ پس در این حالت نیز واکنش انجام نمیگیرد.
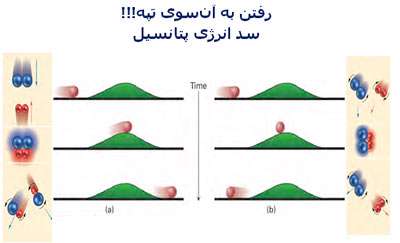
حال ببینیم تغییرات انرژی در طول واکنش به چه صورت است:
انرژی لازم برای واکنش (ΔE ) است. برای تشکیل محصولات، بایستی کمپلکسی از
مجموعه ذرات فعال در واکنش با انرژی بالا نیز تشکیل شود.
کمپلکس فعال شده، نوعی حالت واسطهی مولکولی است که در حین برهمکنش
(برخورد) مولکولهای در حال واکنش با یک تغییر شیمیایی تشکیل میشود؛ بالاترین
مقدار انرژی در حین واکنش به این حالت اختصاص دارد.
انرژی فعال سازی (E[SUB]a[/SUB]) کمترین انرژی جنبشی لازم برای تولید انرژی برخورد مؤثر
است و با این انرژی میتوان به بالای تپه رفت!
در شکل بالا به خوبی دیده میشود که برای این که واکنشی صورت پذیرد، شرایط
لازم برای آن (تعداد و جهت مناسب ذرات واکنش دهنده و انرژی جنبشی کافی آن
ها) چگونه تشکیل محصولات را تحت تأثیر قرار می دهد.
در حالت (a) سیستم، انرژی کافی برای رفتن به آن سوی تپه و غلبه به سد انرژی
پتانسیل را دارد؛ بنابراین محصولات تشکیل میشوند.
در حالت (b) سیستم، انرژی کافی برای عبور از سد انرژی پتانسیل ندارد؛ بنابراین
محصولات این برخورد ناموفق تشکیل نمیشوند.
گفته شد که انرژی فعالسازی، حداقل انرژی لازم برای ایجاد انرژی برخورد مؤثر
است تا واکنش انجام شود. با مقایسهی این مطلب و شکل قبل میبینیم که اگر
شرایط انجام واکنش مهیا باشد و انرژی فعالسازی نیز کافی باشد، میتوان به سد
پتانسیل غلبه کرد.
به نظر شما این سد پتانسیل ناشی از چیست؟
حال ببینیم چه عواملی بر سرعت و کارایی واکنش های شیمیایی تأثیر دارند:
· دمای واکنش: با افزایش دما سرعت انجام واکنش نیز بالا می رود.
· کاتالیزگرها: کاتالیست مناسب، سرعت واکنش را بالا می برد.
· غلظت واکنش دهنده ها: غلظت زیاد واکنش دهنده ها موجب سرعت یافتن
واکنش می شود.
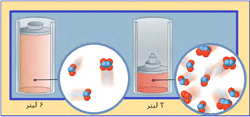
اثر دما بر آهنگ واکنش:
در فرایند تبخیر مولکول های آب در یک ظرف در بستهی نیمه پر، مولکول ها در فضای
گازی بالای آب در حال تبخیر، توزیعی از سرعت های مختلف دارند؛ برخی از این
مولکول ها کند و برخی بسیار سریع حرکت می کنند.
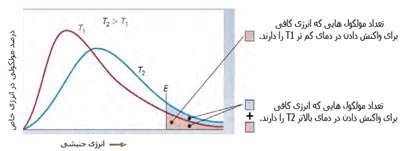
شکل بالا این مطلب را به خوبی نشان میدهد؛
دایرههای آبی، مولکولهاییاند که سرعت حرکت بالایی دارند و دایرههای قرمز،
مولکول هاییاند که سرعت کمی دارند. حال ببینیم تغییر دما چه تأثیری بر روی
سرعت مولکول ها دارد؟
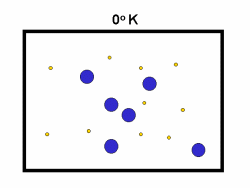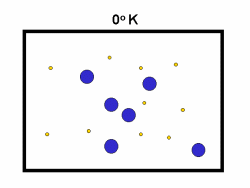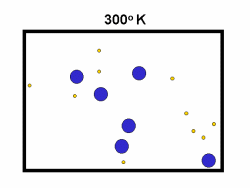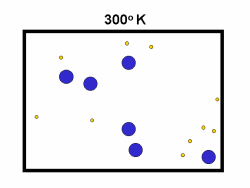
· تنها کسری از مولکولهای نشان داده شده در ناحیهی پایینی منحنی در سمت
راست، انرژی جنبشی کافی برای واکنش دادن دارند.
· کسر بزرگی از مولکولها میتوانند در دماهای بالاتر واکنش دهند.
در زندگی روزمره نیز واکنشهای شیمیایی فراوانی را در همین ارتباط مشاهده
میکنیم؛ به عنوان مثال، آهنگ فاسد شدن غذای منجمد شده نسبت به غذایی
که در دمای عادی نگهداری میشود، کمتر است. همچنین، غذا در زودپز خیلی
سریعتر از حالت عادی پختن غذا میپزد زیرا در دمای بالاتری به جوش میآید
اما همین غذا اگر در منطقهای که ارتفاع بالایی نسبت به سطح دریا دارد پخته
شود، دیر خواهد پخت؛ زیرا فشار پایینتر، نقطهی جوش را پایینتر میآورد.
نقش کاتالیزورها در آهنگ واکنش:
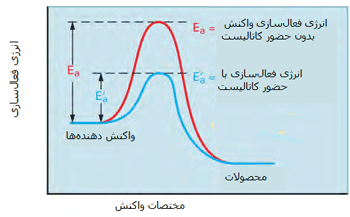
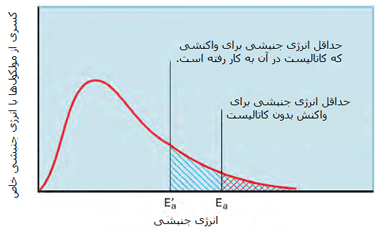
مطابق شکل زیر، یک کاتالیست راهی را فراهم میکند که واکنش با انرژی فعال
سازی کمتری اتفاق بیفتد؛ بنابراین بیشتر مولکولهایی که انرژی جنبشی کم
تری دارند، قادر خواهند بود از سد انرژی پتانسیل عبور کنند.
در شکل دوم، کسری از مولکولها با انرژی کافی برای وارد شدن به برخوردهایی
که باعث انجام واکنش میشوند، در صورت وجود کاتالیست افزایش پیدا میکند
زیرا سد انرژی فعالسازی پایین میآید.
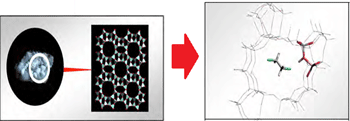
حال مثالی از نقش کاتالیست زئولیت (نوعی سیلیکات آبدار) در انجام واکنش
میآوریم تا این مطلب را به خوبی درک کنید:
زئولیتها جامدهایی با شبکهی کوالانسیاند و دارای حفرهها و کانالهایی
خاص هستند و مولکولهای گازی میتوانند از طریق این کانالها پخش شوند.
زمانی که دو مولکول گاز درون زئولیت با همدیگر روبهرو میشوند، مجبور به
نزدیک شدن به هم در یک جهت ویژه میشوند (این جهت ویژه، جهتگیری
درست برای انجام واکنش است).
این دو مولکول مدت طولانی را با هم میمانند و شانس بیشتری برای واکنش
دارند. طبیعت کاتالیستها این است که به طور مستقیم در واکنش شرکت
میکنند (اما واکنشدهنده یا محصول نیستند) و محیط مناسبی برای انجام
واکنش فراهم کرده و سد انرژی فعالسازی را پایین میآورند.
تأثیر غلظت بر سرعت واکنش:
آهنگ یک واکنش به تعداد برخوردها در واحد زمان نیز بستگی دارد. هرچه
تعداد ذرات موجود در حجم خاص که واکنش در آن صورت میگیرد زیاد باشد،
برخوردهای متوالی بیشتری اتفاق خواهد افتاد و واکنشها با سرعت بیش
تری انجام خواهند گرفت. به شکل زیر که سوختن برادهی فولاد در اکسیژن
را نشان میدهد، توجه کنید:
در ردیف اول، برادهی فولاد در هوا (غلظت کم اکسیژن) حرارت داده میشود.
در ردیف دوم، برادهی فولاد در اکسیژن خاص حرارت داده میشود.
این مشاهده براساس توجیهات بالا کاملاً قابل درک است.
آخرین ویرایش:
کاربر فعال تالار شیمی
کاربر ممتاز
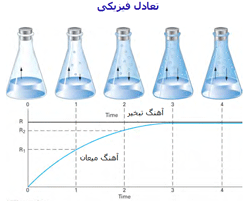
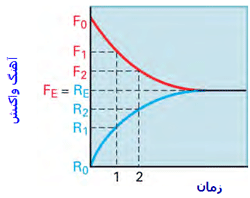
تغییرات آهنگ واکنش در هنگام نزدیک شدن واکنش به حالت تعادل:
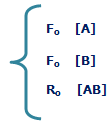
به شکل زیر توجه کنید؛ در لحظهی t=0 مقدار زیادی از مولکولهای A و B وجود
دارد (در t=0 محصول AB تشکیل نشده است) و واکنش رفت سریع است (آهنگ
واکنش رفت با F[SUB]o[/SUB] نشان داده میشود) و واکنش برگشت اتفاق نیفتاده است
(آهنگ واکنش برگشت با R[SUB]o[/SUB] نشان داده میشود).
با گذشت زمان، AB تشکیل میشود و A و B مصرف میشوند، بنابراین طبیعی
است که آهنگ رفت و برگشت تغییر کند. هر چه زمان میگذرد، واکنش رفت کند
تر شده (A و B کمتری باقی مانده) و واکنش برگشت سرعت میگیرد (مولکول
های AB بیشتری تولید شده است).
آهنگ واکنش:
در حالت تعادل، آهنگ واکنش رفت و برگشت دقیقاً با هم مساوی خواهند بود:
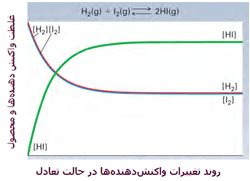
به عنوان یک مثال از بحث قبلی، واکنش گاز هیدروژن با گاز ید را در نظر میگیریم:
این دو گاز برای تشکیل یدید هیدروژن (HI) با هم وارد واکنش میشوند. هنگامی
که سیستم به تعادل میرسد، آهنگ واکنش رفت و برگشت کاملاً با هم برابر می
شوند و غلظت نسبی HI، H[SUB]2[/SUB] و I[SUB]2[/SUB] ثابت باقی میماند. در حالت تعادل، مقدار HI
از H[SUB]2[/SUB] و I[SUB]2[/SUB] بیشتر است. در شکل زیر، روند این واکنش را مشاهده میکنید.
منظور از [HI] غلظت مولکولهای HI در واکنش است.
های تعادلی مختلف با ثابت تعادل واکنش تعریف میشود. این مقادیر در جدول زیر آمدهاند.
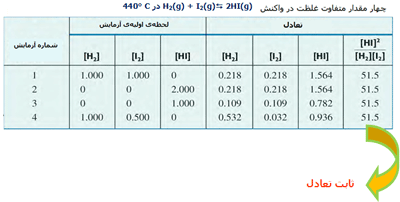
حال ببینیم چگونه میتوان ثابت تعادل را محاسبه کرد؟
برای هر واکنش شیمیایی در یک دمای معین، نسبت حاصلضرب غلظت اجزای سمت
راست واکنش که هر کدام از آنها به توان ضریب خود (تعداد آن محصول) میرسد،
به حاصلضرب غلظت اجزای سمت راست واکنش که آنها نیز به توان ضریب خود می
رسند، مقدار ثابتی دارد که به آن ثابت تعادل (K) گفته میشود.
در واکنش زیر، محاسبهی ثابت تعادل با استفاده از روش ذکر شده بدین صورت خواهد
بود:
K ثابت تعادل واکنش بوده و مستقل از دما و نوع واکنش است.
به عنوان مثال محاسبهی ثابت تعادل واکنش، معادلهی زیر را در نظر میگیریم:
مواد واکنش دهندهی جامد و مایع در اکثر واکنشهای شیمیایی، غلظتهای ثابتی
دارند و در محاسبهی K از آنها صرفنظر میشود:
مقدار ثابت تعادل اطلاعات جالبی راجع به غلظت مواد درگیر واکنش و مورد توجه بودن
واکنش رفت یا برگشت به ما می دهد؛ به عنوان مثال وقتی می گوییم مقدار K یک
واکنش 1 * 10[SUP]9[/SUP] است، یعنی غلظت محصولات به طور چشم گیری بیش تر از غلظت
واکنشدهنده هاست ( 10[SUP]9 [/SUP]* 1 برابر غلظت واکنش دهنده ها است).
برای نمکهایی که به سختی در آب حل می شوند، K[SUB]SP[/SUB] تعریف می شود که ثابت
حاصلضرب انحلال پذیری نام دارد.
مقدار K هر چه که باشد، میتوان آنرا اینگونه تفسیر کرد:
وقتی [ محصولات ] > [ واکنشدهندهها ] و K بزرگ است:
- واکنش، تشکیل محصولات را آسان میکند.
- واکنش در جهت رفت پیشرفت کرده است.
وقتی [ واکنشدهندهها ] > [ محصولات ] و K کوچک است:
- واکنش، تشکیل محصولات را آسان میکند.
- واکنش در جهت برگشت پیشرفت کرده است.
وقتی K از 0.1 تا 10 تغییر میکند و [ محصولات ] تقریبا مساوی با [ واکنش
دهندهها ]:
- مقادیر قابل توجه و محسوسی از هر دو موجود است.
در تمام موارد بالا، سیستم در حالت تعادل قرار دارد.
کاربر فعال تالار شیمی
کاربر ممتاز
کنترل یک واکنش:
در مطالب قبل به ویژگی های سیستمهای در حال تعادل اشاره کردیم و با
ثابت تعادل آشنا شدیم...
حال میخواهیم بدانیم آیا میتوانیم واکنش را به دلخواه خودمان کنترل کنیم؟
جواب مثبت است!
برای اینکه محصول بیشتری تولید کنیم و یا بازده واکنش را بالا ببریم، میتوانیم
تغییرات زیر را در سیستم واکنش ایجاد کنیم:
- تغییر غلظتهای واکنش دهندهها یا محصولات
- تغییر دما
- تغییر فشار و حجم (برای یک واکنش در فاز گازی)
در واکنشهای تعادلی، هر تغییری در سیستم صورت گیرد، سیستم سعی خواهد
کرد به سمتی پیش رود که باز هم حالت تعادل را برقرار کند. تغییرات ذکر شده در
بالا نیز حالت تعادلی سیستم را به طور موقت بر هم می زنند.
اصل لوشاتلیه:
حالت تعادل در هر سیستمی به عوامل موجود در سیستم مانند دما، فشار و غلظت
اجزای مختلف بستگی دارد. این عوامل، پارامتر یا متغیرهای واکنش نامیده میشوند.
یک تغییر در هر کدام از پارامترهای واکنش، ممکن است وضعیت تعادلی سیستم
را تحت تأثیر قرار دهد.
قاعدهی کلی که میتواند تأثیر تغییرات این پارامترها را بر روی حالت تعادل توصیف
کند، توسط اچ. لوشاتلیه (1885) و اف. بارون (1886) فرمولبندی شده ولی بطور
مشترک، اصل لوشاتلیه نامیده میشود.
این اصل، کاربرد سودمند بزرگی برای تمام سیستمهای فیزیکی و شیمیایی دارد.
این اصل بیان میکند هر سیستمی که در معرض تغییری در پارامترهای خود قرار
میگیرد، فرایندهایی در سیستم اتفاق میافتد که با تغییر اولیه مخالفت کنند؛
بنابراین سیستم به یک وضعیت تعادلی جدید میرسد.
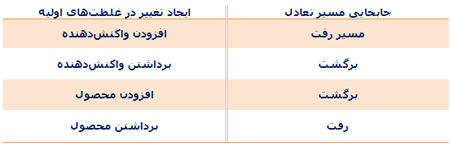
تغییر غلظت واکنشدهندهها یا محصولات:
یک سیستم شیمیایی در حال تعادل در نظر بگیرید. اگر تعادل با تغییر غلظت هر
کدام از اجزای واکنش به هم بخورد، تعادل به جهتی انتقال پیدا خواهد کرد که
سعی در برگرداندن سیستم به وضعیت اصلیاش خواهد کرد. به مثال زیر توجه
کنید:
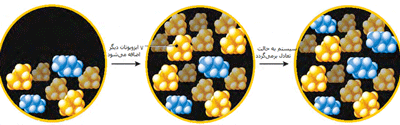
سیستمی از مخلوط 5 مولکول ایزوبوتان و 2 مولکول بوتان در حال تعادل است.
با اضافه کردن هفت ایزوبوتان دیگر، سیستم از حالت تعادل خارج میشود.
شبکهای از دو مولکول ایزوبوتان به مولکول بوتان تغییر میکند تا بازهم مخلوطی
به دست آید که حالت تعادلی برقرار شود. نسبت ایزوبوتان به بوتان، 5 به 2 است.
در واکنش زیر، افزودن BaCl[SUB]2[/SUB] باعث جابجاشدن مسیر تعادل در مسیر رفت خواهد
شد تا وضعیت تعادلی جدید برقرار شود:
در واکنش زیر افزودن Cl[SUB]2[/SUB] به حالت تعادل سیستم، باعث جابجا شدن مسیر تعادلی
سیستم در جهت برگشت خواهد شد:
به نظر شما با این افزایش Cl[SUB]2[/SUB] چه اتفاقی برای غلظت CO خواهد افتاد؟
اثر حجم:
اگر یک سیستم گازی متراکم شود، فشار افزایش پیدا میکند و باعث میشود سیستم
با یک شیفت (جابجایی) در جهت مولکولهای گازی کمتر تا اندازهای از فشار و تغییر
ایجاد شده رهایی پیدا کند.
در حالتی که سیستم منبسط شود، فشار کاهش پیدا میکند و یک شیفت در جهت
مولکولهای گازی بیشتر تا اندازهای به حالت تعادلی اولیه باز میگردد.
در شکل بالا، گاز N[SUB]2[/SUB]O[SUB]4[/SUB] با NO[SUB]2[/SUB] در حال تعادل است:
ابتدا نسبت N[SUB]2[/SUB]O[SUB]4[/SUB] به NO2، مقدار 1 به 2 است (1:2) . سپس حجم سیستم به یک سوم
حجم اولیه کاهش مییابد (سیستم متراکم میشود) و برای اینکه سیستم به تعادل
دوباره برسد، واکنش به سمتی جابجا میشود که این فشار افزایش یافته را کم کند (جهتی
که تعداد مولکولها را کاهش دهد)؛ بنابراین تعادل دوباره برقرار میشود (نسبت N[SUB]2[/SUB]O[SUB]4[/SUB] به
NO[SUB]2[/SUB] اکنون 4:5 است).
جابجایی مسیر تعادل با تغییر دمای سیستم:
با یک مثال این بحث را شروع میکنیم؛ زمانی که یک مول گاز استیلن با دو مول گاز هیدروژن
واکنش نشان دهد، یک مول گاز اتان تشکیل میشود و 311 کیلوژول انرژی آزاد میکند؛ بنابر
این یک واکنش گرماده است.
گرما، محصول دیگر این واکنش است:
ΔH=-311KJ به معنای آزاد شدن 311 کیلوژول انرژی گرمایی از این واکنش است.
در واکنشهای گرماده که با فرمول کلی:
مشخص میشوند، افزودن گرما و حرارت دادن به سیستم باعث جابجایی مسیر تعادل در
جهت برگشت میشود (یعنی واکنش دهندهی بیشتر). به همین ترتیب، برداشتن حرارت
و گرما از سیستم باعث جابجایی تعادل در مسیر رفت میشود (تا محصول بیشتری تولید
کند).
به مثال زیر توجه کنید:
با کاهش دمای سیستم در این واکنش گرماده (برداشتن حرارت از سیستم)، مسیر
رفت واکنش تعادلی، پیشرفت میکند تا محصول بیشتری تولید شود!
در واکنشهای گرماگیر که با فرمول کلی:
مشخص می شوند، افزودن حرارت به سیستم باعث جابجایی و شیفت تعادل به سمت
رفت واکنش می شود (محصول بیش تری تولید می شود) و برداشتن حرارت و کم شدن
دمای سیستم باعث شیفت تعادل به سمت برگشت می شود (واکنش دهنده ی
بیش تر). به مثال زیر توجه کنید:
با افزایش دمای سیستم در این واکنش گرماگیر، واکنش در جهت رفت پیش میرود
تا اکسیژن و هیدروژن بیشتری تولید کند.